
题目列表(包括答案和解析)
3.某物质经分析后,只含一种元素,此物质
A.一定是纯净物 B.一定是一种单质
C.一定是混合物 D.可能是纯净物或混合物
2.下列反应既是氧化还原反应,又是吸热反应的是
A.铝片与稀H2SO4 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2反应 D.甲烷在O2中的燃烧反应
1.元素的性质呈周期性变化的根本原因是
A.元素原子量的递增,量变引起质变 B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化 D.元素的金属性和非金属性呈周期性变
25. (17分)如下图装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:
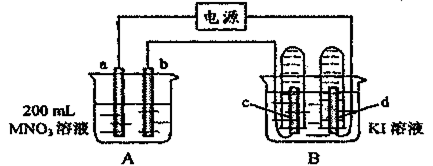
(1)a为 极,c极的电极反应式为 。
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是: ,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为 .
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了 moL气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL,取这种溶液加入到25.0mL 0.100mol·L-1 HCl溶液中,当加入31.25mL溶液时刚好沉淀完全。
试计算:电解前A烧杯中MNO3溶液的物质的量浓度。
24.(14分)A、B、C三种元素均为短周期元素,且原子序数依次增大,三种元素原子序数之和为35,A、C同主族,B+ 核外有10个电子,则
(1)A、B、C三种元素分别是___________、______________、______________。
(2)A、B、C之间可形成多种化合物,其中属于离子化合物的化学式分别为____________、______________、____________(任举三种)。
(3)用电子式表示B和C形成化合物的过程__________________________________
23.(3分)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水。已知室温下1g甲硅烷自燃放出44.6kJ,
其热化学方程式为
22.(12分) 某化学反应2A(g)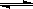 B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:
|
时间
实验序号 |
1 |
10 |
20 |
30 |
40 |
50 |
60 |
|
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空: (1)实验1中,在10-20 min时间内,以A的速率表示的平均反应速率为 mol•L-1•min-1 (2)实验2中,A的初始浓度c2= mol•L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。 (3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3 v1(填“>”“=”或“<”),且c3 1.0mol•L-1(填“>”“=”或“<”)。 (4)比较实验4和实验1,可推测该反应的正反应是 反应(填“吸热”或“放热”),理由是 。
21. (4分) 有下列各组粒子或物质,请用字母回答问题:
A.氘和氚 ; B.金刚石和石墨; C.CH3CH3和CH3CH2CH2CH3 ; D.正丁烷和异丁烷;
E.氯气和液氯 ; F.二氯甲烷和二氟甲烷;
(1) _____组两种粒子互为同位素。 (2) _____组两种物质互为同素异形体。
(3) _____组两种物质互为同分异构体。 (4)_____ 组两种物质互为同系物。
20. 已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且氧气中1 mol O=O键完全断裂时吸收热量496 kJ水蒸气中1 mol H―O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
19.下列说法正确的是
A、可逆反应的特征是正反应速率和逆反应速率相等 B、在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 C、在其他条件不变时,升高温度可以使平衡向放热反应方向移动 D、在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com