
题目列表(包括答案和解析)
4.下列物质中,既含有离子键,又含有非极性键的是 ( )
A.NaOH B.Na2O2 C.MgCl2 D.H2O2
3.下列数字为几种元素的核电荷数,其中核外最外层电子数最多的是 ( )
A.8 B.14 C.20 D.33
2.元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
1.若用x代表一个中性原子中核外的电子数,y代表此原子的原子核内的质子数,z代表原子的原子核内的中子数,则对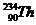 的原子来说
( )
的原子来说
( )
A. x=90 y=90 z=234 B. x=90 y=90 z=144
C. x=144 y=144 z=90 D. x=234 y=234 z=324
27.(8分)如图所示,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸(B、C中金属棒分别用导线连接)。
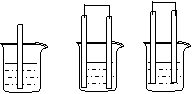 (1)A中反应的离子方程式为 ;
(1)A中反应的离子方程式为 ;
|
一段时间后溶液的pH值 (填“变大”、“变小”、“不变”);
A B C(3)C中被腐蚀的金属是 ,装置中总反应方程式为 ,比较A、B、C中铁反应的速率由快到慢的顺序为 (用字母ABC表示) 。
26.(11分)某研究小组制取氯气,并将氯气通入烧碱溶液制备少量消毒液(主要成分是NaClO),设计了下列装置,回答有关问题:
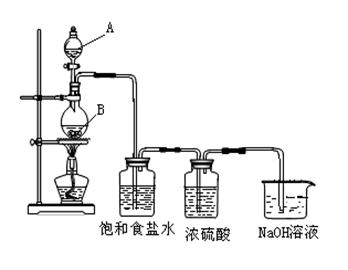
(1)仪器A的名称为 ,B装置中反应的离子方程式为 ;
(2) 饱和食盐水的作用是 ,能否省去盛有浓硫酸的洗气瓶? (回答“能”或“不能”),理由是
;
(3)生成消毒液的反应的离子方程式为 。
(4)工业上制取氯气的反应的化学方程式为 。
25.(7分)某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质
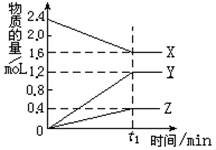 的量随时间的变化曲线如右图。依图回答:
的量随时间的变化曲线如右图。依图回答:
(1) 该反应的化学方程式可表示为 ___ __________ _______。
(2)反应起始至t1min(设t1=5),Y的平均反应速率是_____ __ ____。
(3)在t1min时,该反应达到了____ ______状态,下列可判断反应已达到该状态的是___ _______(选填字母)
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为2:3
C.混合气体的密度不变 D.生成1molZ的同时生成2molX
E.X、Y、Z物质的量之比等于系数比 F. 混合气体的总压强不再发生改变
23.(9分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子最外层上的电子数为最内层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;A与E同主族;A和E 这两种元素与D都能形成X2Y、X2Y2型化合物。
(1) 写出元素的名称:A 、 C 、D________;
(2) 分别指出B、D两元素在元素周期表中的位置:B 、 E ;
(3) 指出下列物质中的化学键类型:B的单质(能导电) ,A、C形成的化合物_________,A、D、E形成的化合物 。
|
|
C.2Mg+2H2O==Mg(OH)2+H2 D.CO2+C====2CO
E.Ca(OH)2+2NH4Cl==CaCl2+2NH3+2H2O
(2)拆开或形成1mol化学键吸收或放出的能量叫键能。已知1mol氨气分解成氮气和氢气要吸收46.19kJ的热量,又知H-H键键能为436.4 kJ•mol-1,N≡N键键能为941.7 kJ•mol-1,则N-H键键能为___________ kJ•mol-1(1个氨分子中含有3个N-H键,1个氮气分子中含有一个N≡N键,1个氢气分子中含有一个H-H键)。
22.(6分)(1)元素周期表体现了元素周期律,即元素的性质随着___ ______的递增呈现__ ___的变化。
(2)元素周期表前四周期元素中失电子能力最强的元素是 (填元素符号,下同),得电子能力最强的元素是
 (3)短周期元素X、Y、Z在周期表中的位置关系如图所示,则①Y、Z元素的气态氢化物的稳定性 > (填化学式)。
(3)短周期元素X、Y、Z在周期表中的位置关系如图所示,则①Y、Z元素的气态氢化物的稳定性 > (填化学式)。
②三种元素形成的单质中熔点最高的是 (填化学式)。
21.(9分)(1)原子种类由______________决定;元素种类由_______________决定;元素的化学性质主要由该元素原子的__________________决定。
(2)写出表示含有8个质子,10个中子的原子的化学符号: 。
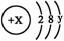
(3)某简单微粒的结构示意图为 且X、Y 均为不大于20的正整数,据此回答下列问题:
①若该微粒一般情况下不与其它元素的原子反应,这种微粒的符号是
②若该微粒有很强的氧化性,且只需得到一个电子就能达到稳定结构,这种微粒的结构示意图为
③若该微粒为一价阳离子,且对应的碱为可溶性强碱,则x= ,y= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com