
题目列表(包括答案和解析)
24、(6分)把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:2X(g)+Y(g) = nZ(g)+2W(g) 。2 min 末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.1 mol·L-1·min-1 ,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率 mol·L-1·min-1。
(2)在相同条件下,当反应达到平衡时混合气体的物质的量为原来的1.375倍,则该反应达到最大限度时Z的物质的量为多少?(请写出计算过程)
答案(0.05 mol·L-1·min-1 2分 0.25 mol·L-1 n=4 2分)
瑞昌一中
23、(7分)某化学兴趣小组为探究氯与溴的非金属性的强弱,设计了如下实验:
(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)
实验步骤如下:
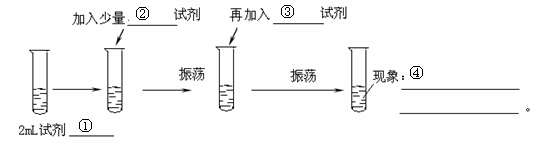
请回答:
(1)试剂①为 ,试剂③为 。
(2)现象④为 : 可以证明氯的非金属性 (填强于、弱于)溴的非金属性,此反应的离子反应方程式为: 。
答案:(8分)NaBr溶液;氯水;四氯化碳;分成两层,上层无色,下层棕色(或橙色)。
强于;Cl2 + 2 Br- = 2Cl- + Br2
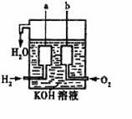
22、(10分)(1)美国阿波罗宇宙飞船上使用了一种新型燃料电池装置,其构造如右图所示:a、b两个电极均由多孔的碳块组成,通入的氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电。其中一极反应式为:O2+2H2O+4e-=4OH-,则另一极为 极。
(2)理论上讲,任何自发的氧化还原反应都可以设计成原电池。
请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池,并
回答下列问题:
①该电池的电解质溶液是 。负极的电极材料为 ,
该装置是将 能转化为 能。
②电解质溶液中出现的现象是 ,若反应中有1.204×1023个电子转移,则电池中析出了 g单质银。
答案:(1)2H2+4OH--4e-=4H2O
(2)①AgNO3溶液, 氧化 Cu-2e-=Cu2+
②质量增加 21.6
答案:(10分)
(1)元素A位于第三周期ⅠA族, (2分); 离子键、极性共价键(各1分)。
(2)极性。
(3)B与D形成稳定的化合物的化学式为Al2O3,Al2O3+2OH-====2 AlO2-+H2O
(4) Cl2+2OH-=Cl-+ClO-+H2O。
21、(4分)氢气燃烧生成液态水的化学方程式是2H2(g)+ O2(g) ===2H2O(l)在一定温度和压强条件下,2molH2(g)和1molO2(g)完全化合生成2molH2O(l)所放出的热量为572 kJ1,
请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
(2)相同条件下1molH2O(l)完全分解为H2(g)和O2(g)所吸收的热量为 kJ。
(3)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)572 kJ
(4)与化石燃料相比,利用氢能源很多优点,请说出其中一 点 。
 答案:(1)小于(2)286
(3)小于(4)产物无污染(其它合理均可得分)
答案:(1)小于(2)286
(3)小于(4)产物无污染(其它合理均可得分)
19.(8分)A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;7.8gB的氢氧化物恰好能与100mL3mol/L盐酸完全反应;B原子核中质子数比中子数少1。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素A位于 (填周期和族),它的最高价氧化物对应的水化物的电子式为__ ,其中含有的化学键有______________。
(2)D的氢化物属于 分子(填极性、非极性)。
(3)B与D形成的化合物与A的最高价氧化物对应的水化物反应的离子方程式:_______ 。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为___________ 。
20(6分)某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
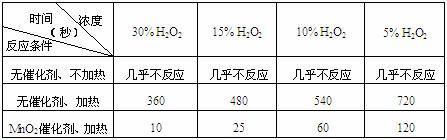
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解
速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
。
⑵将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
|
催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
|
粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
|
块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2发生的化学反应方程式_______________ _________。
②实验结果说明催化剂作用的大小与________ ________________有关。
答案:(7分)⑴① 温度 、 催化剂
② 升高温度化学反应速率增大或加催化剂化学反应速率增大
⑵①______2H2O2 = 2H2O+O2↑______。
②_______催化剂的聚集状态或表面积______。
18、(7分)A、B、C、D四种元素在周期表中分别处于元素X的四周,已知X元素最高价氧化物的化学式为XO3,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
|
E |
B |
|
|
…A |
X |
C… |
|
|
D |
|
(1)排列C、D、X最高价氧化物对应水化物的酸性由强到弱的顺序 ,排列A、B、X气态氢化物的稳定性由强到弱的顺序 (用化学式表示)。
(2)E的氢化物是由 (填“极性”“非极性”)键形成的,且能与E的最高价氧化物对水化物发生反应生成一种盐,写出该反应的离子方程式 .
(3)用电子式表示C和11号元素形成化合物过程: ,
17、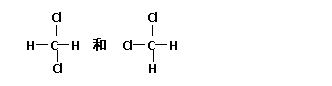 (4分)将下列物质进行分类:①
(4分)将下列物质进行分类:①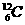 与
与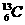 、②O2与O3、③正丁烷和异丁烷、④金刚石和
、②O2与O3、③正丁烷和异丁烷、④金刚石和
石墨、⑤CH3CH2CH2CH3和CH3CH2CH2CH2CH2CH3、⑥ 并对各组物质的性质异同点进行分析,用数字序号回答问题:
(1)互为同位素的是_________________
(2)互为同分异构体的是
(3)属于同一化合物的是
(4)互为同系物的是__________________
答案:(4分)(1)①(2)③(3)⑥(4)⑤
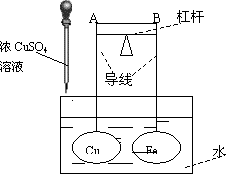
16、如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化) ( ) A.杠杆为导体或绝缘体时,均为A端高B端低 B.杠杆为导体或绝缘体时,均为A端低B端高 C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低 D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
第II卷 非选择题(有8小题,共52分)
0.06 mol·L-1 需20s,那么由0.06 mol·L-1降到0.024mol·L-1需要的反应时间为( ) A. 等于18s B.等于 12s C. 大于18s D.小于18s
15、在恒温恒容的容器中进行反应2SO2+O2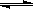 2SO3,若反应物浓度由 0.1 mol·L-1降到
2SO3,若反应物浓度由 0.1 mol·L-1降到
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com