
题目列表(包括答案和解析)
23. (9分)在425℃时,1L密闭容器中进行反应:H2(g)+I2(g) 2HI(g),以不同的方式加入反应物或生成物均能达到平衡(如下图)
2HI(g),以不同的方式加入反应物或生成物均能达到平衡(如下图)
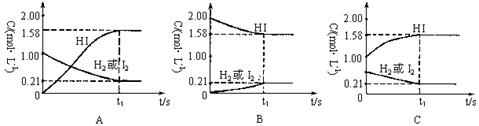
(1)图示三种情况的反应物、生成物的初始浓度和平衡浓度如下,请将空格填满。
|
图像 |
C/(mol·L-1) |
|||||
|
H2起始 |
H2平衡 |
I2起始 |
I2平衡 |
HI起始 |
HI平衡 |
|
|
A |
1.00 |
|
1.00 |
0.21 |
0 |
1.58 |
|
B |
0 |
0.21 |
0 |
|
2.00 |
|
|
C |
0.50 |
|
0.50 |
|
1.00 |
|
(2)以上三种情况达到化学平衡 (填“是”、“不是”)相同平衡状态。理由是:
。
由图中的事实可以说明化学平衡具有哪些特征?
。
(3)恒温、恒容条件下,要使同一可逆反应,建立相同平衡状态的条件是什么?
。
22.(6分)发射卫星时可用肼(N2H4)为燃料和二氧化氮(NO2)做氧化剂,
两者反应生成氮气和气态水。
已知:N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ/mol
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
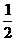 H2 (g) +
H2 (g) + 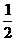 F2 (g) = HF (g)
△H = -269kJ/mol
F2 (g) = HF (g)
△H = -269kJ/mol
H2
(g) + 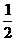 O2 (g) = H2O (g)
△H = -242kJ/mol
O2 (g) = H2O (g)
△H = -242kJ/mol
(1)肼和二氧化氮反应的热化学方程式为:
;
(2)有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大,试写
出肼和氟气反应的热化学方程式:
。
21.(9分)已知H+(aq) + OH-(aq) = H2O(l) △ H= -57.3kJ/mol ,回答问题。
(1)用含20gNaOH的稀溶液跟足量稀盐酸反应放出____________ kJ的热量。
(2)用含2molH2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热为:
。
(3)如果将(1)反应中的稀盐酸换成稀醋酸时,反应放出的热量
(填“大于”、“小于”、“等于”)(1)放出的热量。
20.(04江苏)在容积固定的密闭容器中发生如下反应:
A(g)+3B(g)  2C(g) △H<0
2C(g) △H<0
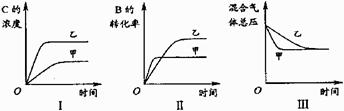 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是
A. 图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B. 图Ⅱ研究的是温度对反应的影响,且甲的温度较高
C. 图Ⅱ研究的是压强对反应的影响,且甲的压强较高
D. 图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
第Ⅱ卷 (非选择题,共40分)
19. 对反应2NO2(g) N2O4(g),在一定条件下达到平衡。在温度不变时,欲使
N2O4(g),在一定条件下达到平衡。在温度不变时,欲使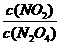 的比值增大,应采取的措施是( )
的比值增大,应采取的措施是( )
A.体积不变,增加NO2的物质的量 B.体积不变,增加N2O4的物质的量
C.使体积增大到原来的2倍 D.保持压强不变,充入N2
18. 某温度下,反应N2O4
(g) 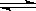 2NO2(g) (正反应吸热) 在密闭容器中达到平衡,下列说法错误的是
2NO2(g) (正反应吸热) 在密闭容器中达到平衡,下列说法错误的是
A. 加压时(体积变小),将使正反应速度增大
B. 保持体积不变,加入少许NO2,将使正反应速度减小
C. 保持体积不变,加入少许N2O4,再达到平衡时,颜色变深
D. 保持体积不变,升高温度,再达平衡时颜色变深
17.在下列各说法中,正确的是( )
A.△H>0表示放热反应,△H < 0表示吸热反应
B.热化学方程式中的化学计量数可以是整数,也可以是分数
C.1mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
16.下列说法不正确的是 ( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应都不需要加热就能发生
C.一些吸热反应在常温、常压条件下也能自发进行
D.化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量
15. 已知:H2(g)+I2(g)  2HI(g)的平衡常数为K1 ;
2HI(g)的平衡常数为K1 ;
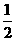 H2(g)+
H2(g)+ 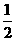 I2(g)
I2(g) HI(g)的平衡常数为K2,则K1、K2的关系为 ( )
HI(g)的平衡常数为K2,则K1、K2的关系为 ( )
A. K1= 2K2 B. K1= K22 C. K1 = K2 D. K1= K2
14. 在相同条件下(T=500K),有相同体积的甲、乙两个容器。甲容器中充入1 g SO2和1 g O2;乙容器中充入2 g SO2和2 g O2。下列叙述错误的是
A.化学反应速率:乙>甲 B.平衡后的浓度:乙>甲
C.SO2的转化率:乙>甲 D.平衡后SO2的体积分数:乙>甲
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com