
题目列表(包括答案和解析)
8.下列能达到实验目的的是 ( )
A.在容量瓶中加入一体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B.用通过灼热氧化铜的方法除去二氧化碳中混有的一氧化碳
C.用玻璃棒搅拌漏斗中的液体以加快过滤速度
D.加入盐酸以除去硫酸钠中的少许碳酸钠杂质
7.下列说法正确的是 ( )
A.1 mol物质的质量叫做该物质的摩尔质量
B.两个等容容器,一个盛一氧化氮,另一个盛N2、H2混合气,同温同压下两容器内气体分子总数一定相同,原子总数也相同
C.将98 g H2SO4溶于500 mL水中所得到溶液中硫酸的物质的量浓度为2 mol/L
D.等物质的量的O2和O3其质量相等
6.下列说法中正确的是 ( )
A.1 mol·L-1的NaCl溶液是指此溶液中含有1 mol NaCl
B.从1L 0.5mol·L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol·L-1
C.0℃时,1 mol Cl2的体积约为22.4 L
D.1 mol·L-1的CaCl2溶液中Cl-的物质的量浓度为2 mol·L-1
5.体积相同的某营养液两份,其配方如下:
|
|
KCl |
K2SO4 |
ZnSO4 |
ZnCl2 |
|
(1) |
0.3 mol |
0.2 mol |
0.1 mol |
/ |
|
(2) |
0.1 mol |
0.3 mol |
/ |
0.1 mol |
两份营养液中各离子浓度 ( )
A.完全相同 B.完全不同 C.仅c(K+)相同 D.仅c(Cl-)相同
4.下列实验可行的是 ( )
A.用澄清石灰水检验CO中含有的CO2
B.用BaCl2除去NaOH溶液中混有的少量Na2SO4
C.用乙醇从碘水中萃取碘
D.用溶解、过滤的方法分离CaCl2和NaCl固体混合物
3.相等物质的量的CO和CO2相比较,下列有关叙述中正确的是 ( )
①它们所含的分子数目之比为1∶1 ②它们所含的氧原子数目之比为1∶2
③它们所含的原子总数目之比为2∶3 ④它们所含的C原子数目之比为1∶1
⑤它们所含的电子数目之比为7∶11
A.①和④ B.②和③ C.④和⑤ D.①②③④⑤
2.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钾和单质碘的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
1.下面是人们对于化学科学的各种常见认识,其中错误的是 ( )
A.化学面对现代日益严重的环境问题显的无能为力
B.化学将在能源、资源的合理开发和安全应用方面大显身手
C.化学是一门具有极强实用性的科学
D.化学是一门以实验为基础的自然科学
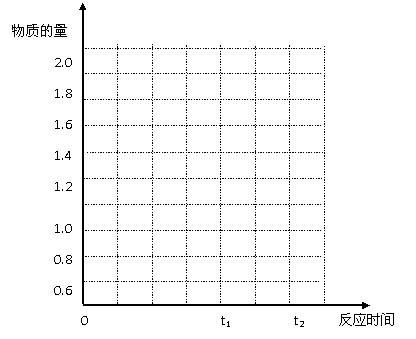
25. (10分)将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:
2SO2(g)+O2(g) 2SO3(g) △H﹤0
2SO3(g) △H﹤0
当反应进行到时间t1时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
⑴反应进行到t1时,SO2的体积分数为 。
⑵若在t1时充入一定量的氩气(Ar),SO2的物质的量将 (填“增大”、“减小”或“不变”)。
⑶若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量
2.1mol(填“<”、“>”或“=”),并简单说明原因:
⑷若其它条件不变,在t1时再加入0.2molSO2、0.1molO2 和1.8molSO3,
在图中作A从t0→t1→t2点这段时间内SO2的物质的量变化曲线。
24. (6分) 氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 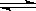 2NH3(g) △H=
-92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g) △H=
-92.4kJ/mol他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A. 采用较高压强(20Mpa~50Mpa)
B. 采用500℃的高温
C. 用铁触媒作催化剂
D. 将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(2)在一定温度下,将1 mol N2
和3 mol H2
混合气体充入一容积不变的密闭容器中,发生如下反应:N2(g)+3 H2 (g) 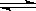 2NH3 (g);保持温度不变,反应达到平衡时,容器中气体压强为起始时的
2NH3 (g);保持温度不变,反应达到平衡时,容器中气体压强为起始时的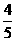 ,平衡状态记为P。则:
,平衡状态记为P。则:
(a) 平衡时容器中NH3 的体积分数是 。
(b)若保持温度不变,开始时向容器中加入a mol N2 、b mol H2和c mol NH3 ,要使反应向逆反应方向进行,且达到平衡后各气体的物质的量与原平衡状态P相同,则起始时,c的取值范围是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com