
题目列表(包括答案和解析)
21.(1)该粒子为 ;
(2)该粒子可能是 、 、 ;
(3)离子方程式: 。
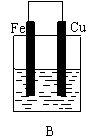
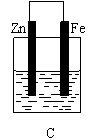
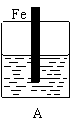
26.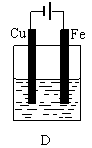 (10分)某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。
(10分)某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。
试回答:高*考*资*源*网
(1)B装置中Cu电极上的电极反应式为 ,D装置中Fe电极上的电极反应式为 ;
(2)D装置中的实验现象有 ,若用电流表测量反应时通过导线的电子流量为0. 2mol,则Fe电极的质量变化为 ;
(3)比较四个装置中Fe片被腐蚀的速率由快到慢的顺序是 (用A、B、C、D表示)。
宁波市2009学年第二学期期末考试
高一化学答题卷高*考*资*源*网
25.(9分)“西气东输”是西部开发的重点工程,这里的“气”是指天然气,其主要成分是甲烷。水煤气中主要成分是CO和H2,二者的体积比为l :l。已知:在120℃和一个大气压下,H-H键能为436 kJ/mol,O=O键能为496 kJ/mol,H-O键能为463 kJ/mol ;1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;l mol CH4气体完全燃烧生成CO2气体和气态水放出802 kJ热量。
(1)写出120℃和一个大气压下,H2完全燃烧生成气态水的热化学方程式 ;
(2)相同条件下,若l mol CH4气体完全燃烧生成CO2气体和液态水,放出的热量 802 kJ;(选填“>”、“=”、“<”)
(3)忽略水煤气中其他成分,燃烧等体积的CH4和水煤气,所得热量之比约为 ;
(4)请结合以上计算结果,叙述相比于水煤气,天然气作为燃料的两个优点:
。
24.(10分)某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0-1、1-2、2-3、3-4、4-5 min)反应速率最大 ,你认为原因是 ;高*考*资*源*网
(2)4-5 min时间段的反应速率最小,你认为原因是 ;
 (3)求2-3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=
;
(3)求2-3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=
;
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质: A.H2O B.NaCl溶液 C.Na2CO3溶液 D.Cu粉 E.CuSO4粉末;
你认为可行的是(填编号) 。
23.(10分)有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示。E的氢氧化物是两性氢氧化物,
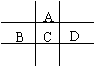 E的阳离子与A的阴离子核外电子层结构相同。
E的阳离子与A的阴离子核外电子层结构相同。
请回答下列问题:
(1)B元素在周期表中的位置为 ;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其电子式为 ;
(3)向D与E形成的化合物的水溶液中滴入NaOH溶液直至过量,观察到的现象是 ,最后阶段反应的离子方程式为 ;
(4)B、C、D、E的最高价氧化物的水化物的酸性从强到弱的顺序为(物质用化学式表示) 。
22.(9分)有下列一组物质: He、Cl2、CH4、Na2O2、Ba(OH)2、NO2、KNO3、H2SO4,请从中选择,用化学式填写下列空白:
(1)只含有共价键,不含其他化学键的化合物有 ;
(2)既含有共价键又含有离子键的物质有 ;
(3)能在水中发生氧化还原反应的有 。
20.普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入
MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-
= 2NH3+H2。根据以上所述判断下列结论不正确的是
A.工作时Zn为负极,发生还原反应
B.工作时电流由碳极经外电路流向Zn极
C.输出电流时碳棒上发生还原反应
D.长时间使用后内装糊状物可能流出,腐蚀用电器
第Ⅱ卷(非选择题,共55分)高*考*资*源*网
|
|
|
|
(1)当x-y=10时,该粒子为 (选填“原子”或“阳离子”、“阴离子”);
(2)当y=8时,该粒子可能是(用化学式表示,任填3种) 、 、 ;
(3)请写出工业上制取y=7元素对应单质时的离子方程式:
。
19.某条件下在密闭容器中发生反应X2 +
3Y2 2Z2 ,右图是反应过程中,反应速
2Z2 ,右图是反应过程中,反应速

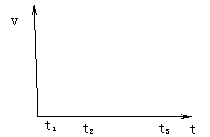 率(v)与时间(t)的关系曲线,下列叙述正确的是
率(v)与时间(t)的关系曲线,下列叙述正确的是
|
 进行而减小
进行而减小

|
|
反应不再进行
D.从关系曲线可知,反应开始时体系中只有X2和Y2
18.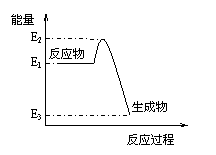 根据右图提供的信息,下列所得结论正确的是
根据右图提供的信息,下列所得结论正确的是
A.该反应是吸热反应
B.该反应的生成物比反应物稳定
C.该反应一定可以设计成为原电池
 D.该反应向外界放出的热量为E2-E3
D.该反应向外界放出的热量为E2-E3
17.下列说法或表示方法不正确的是
A.燃料的燃烧反应都是放热反应
B.绿色植物进行光合作用时,能把光能转化为化学能
C.分子的热稳定性主要取决于分子内化学键的键能大小,与分子间作用力无关
D.已知:N2(g)+3H2(g) 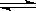 2NH3(g)
△H=-92.4 kJ·mol-1,则说明相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放热92.4 kJ
2NH3(g)
△H=-92.4 kJ·mol-1,则说明相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放热92.4 kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com