
题目列表(包括答案和解析)
21.下列说法正确的是( )
A.酸性氧化物在常温下均呈气态
B.元素的非金属性强,其单质的活泼性也一定强
C.非金属元素间相互结合形成的化合物一定是共价化合物
D.共价化合物的分子中一定不含离子键
20.实验室制取H2的反应中,为了加快铁片与稀硫酸反应的速率从而快速获得H2,可以采用的措施是( )
A.用高纯度铁块替代普通铁块 B.将稀硫酸改为浓硫酸
C.往反应体系中加入少量碳粉 D.稀硫酸中再加入稀硝酸增加酸度
19.若不断地升高温度,实现“雪花à水à水蒸气à氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的相互作用依次是 ( )
A.氢键;分子间作用力;非极性键 B.氢键;氢键;极性键
C.氢键;极性键;分子间作用力 D.分子间作用力;氢键;非极性键
18.在一2升密闭容器中充入2molS02 和2molO2 ,化学方程式是2S02 + O2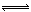 2S03 。经测定反应开始后3s末O2的物质的量为1.4mol,则3 s内SO2的反应速率为( )
2S03 。经测定反应开始后3s末O2的物质的量为1.4mol,则3 s内SO2的反应速率为( )
A.0.6 mol L-1·s-1 B.0.2 mol/(L·s)
C.0.3 mol L-1·s-1 D.0.4mol/(L·s)
17.已知2SO2+O2 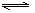 2SO3为放热反应,对该反应的下列说法中正确的是( )
2SO3为放热反应,对该反应的下列说法中正确的是( )
A.该反应的正、逆反应均为放热反应 B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量 D.因该反应为放热反应,故不必加热就可发生
16.氢氧燃料电池已用于航天飞机,它是以铂作电极,KOH溶液作电解质溶液,
正极反应为:O2 + 2H2O + 4e- = 4OH- ,下列叙述不正确的是( )
A.负极反应为:2H2 + 4OH- -4e- =4H2O B.燃料电池的能量转化率可达100%
C.是一种高效、环境友好的发电装置 D.供电时的总反应为:2H2 + O2 = 2H2O
15.已知:①能量越低的物质就越稳定,②白磷转化成红磷是放热反应。据此,下列判断或说法中正确的是 ( )
A.在相同的条件下,红磷比白磷稳定 B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的性质相同 D.红磷容易发生自燃而白磷则不会自燃
14.人造地球卫星上使用的一种高能电池--银锌蓄电池,其电池的电极反应式为:
Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化银是( )
A.负极,被氧化 B.正极,被还原 C.负极,被还原 D.正极,被氧化
13.氮族元素(即周期表中第VA族元素)包含7N、15P、33As、51Sb、83Bi五种元素。下列关于氮族元素的推断中不正确的是( )
A.As的氢化物最稳定 B.P的氢化物沸点最低
C.Sb原子半径比As原子半径大 D.H3AsO4的酸性比H3PO4的酸性弱
12.下列关于化学变化的说法不正确的是( )
A.化学变化总是有新物质生成
B.化学变化过程总是伴随能量变化
C.化学变化过程总是有电子转移
D.化学变化就是旧化学键断裂和新化学键形成的过程
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com