
题目列表(包括答案和解析)
31.(10分)某元素R的最高正价与负价的代数和为4,且该元素在其气态氢化
物中的质量分数为94.1%,且核内质子数等于中子数,请推出该元素。


30.(11分)下表为元素周期表中的一部分, 表中列出6种元素在周期表中的位置。按要求回答下列各题:
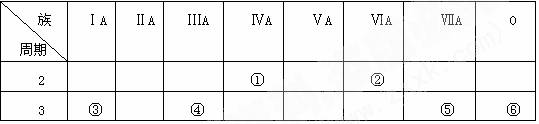
(1)化学性质最不活泼的元素符号是____________。
(2)金属性最强的单质与水反应的离子方程式是__________________________。
(3)元素④和⑤的原子半径的大小关系是_____>_____(填元素符号)。
(4)画出⑤的离子结构示意图_____________,离子电子式为 。
(5)相对分子质量最小的氢化物的电子式为________________。
(6)写出实验室制取⑤元素组成的单质的离子方程式_____________ _________ 。
(7) 沸点最高的非金属氢化物是 ,沸点高的原因是 。
(8)②和③所形成的化合物的电子式为 、 。
附加题:
29.(6分)A、B、C、D四种元素在周期表中分别处于元素X的四周,已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它所在的同族中最小的。试确定:
(1)各元素的符号:
A B C D
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序 。
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序 。
28.(7分)在水溶液中,YO3-与S2-发生反应的离子方程式为:YO3-+3S2-+6H+=Y-+3S↓+3H2O.
请回答:(1)此反应中_______ 发生氧化反应,氧化剂是_______ 。
(2)YO3-中Y的化合价是_______ 。
(3)Y元素原子的最外层电子数是_______ ,它可能处于第_______ 族。
|
|
B |
|
|
…A |
X |
C… |
|
|
D |
|
27.(7分)化学反应过程中伴随能量的变化,研究化学反应中能量变化意义重大。
(1)工农业生产和日常生活中通常通过物质燃烧来获得能量。确保物质燃烧
的两个条件是_____________ 、______________________ 。
(2)铅蓄电池是机动车辆常用的化学电源,其反应原理为:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
该电池放电时,其能量转化的形式是______________________ ,
负极反应式为 ,正极材料是 。
(3)氢气被认为是理想的“绿色能源”。为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可以持续利用的制取氢气的方法
是 , 氢气为 次能源。
A.电解水 B.锌和稀硫酸反应 C.光解海水 D.以石油、天然气为原料
26.(4分)用电子式表示下列化合物的形成过程
(1)H2S ;
(2)MgF2 。
25.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:
A(s)+2B(g)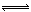 C(g)+D(g)当下列物理量不再发生变化:
C(g)+D(g)当下列物理量不再发生变化:
①单位时间内消耗A的物质的量 ②容器内气体的压强 ③混合气体的总物质的量 ④B的物质的量浓度,⑤混合气体的总质量,则能表明该反应已达到平衡状态
的是( )
A.①④⑤ B.②③⑤ C.②③④ D.只有④
24.下列关于化学反应限度的说法中正确的是( )
A.当一个可逆反应达到平衡状态时,这就是这个反应所可能达到的最大限度
B.当一个可逆反应达到平衡状态时,这个反应的逆反应速率达到该条件下的最大值
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D.化学反应的限度不可以通过改变条件而改变
23.可逆反应2A(g)+3B(g) 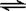 2C(g)+D(g)在四种不同条件下的反应速率分别为:
2C(g)+D(g)在四种不同条件下的反应速率分别为:
①υ(A)=0.5mol·L-1·s-1;②υ(B)=0.6mol·L-1·s-1;③υ(C)=0.75mol·L-1·s-1;④υ(D)=0.4mol·L-1·s-1,则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
22.A、B两元素的阴离子具有相同的电子层结构,A元素的阴离子半径大于B元素的阴离子半径,C和A两元素的原子核外电子层数相同,C元素的原子半径大于A元素的原子半径,则A、B、C三种元素的原子序数的关系是( )
A.A>B>C B.B>A>C C.C>A>B D.A>C>B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com