
题目列表(包括答案和解析)
4、下列电子式中,正确的是( )
A、 ∶N∶∶∶N∶ B、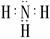 C、
C、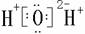 D、 Na+[∶Cl∶]
D、 Na+[∶Cl∶]
3、下列反应中,既属于氧化还原反应,又是吸热反应的是( )
A、Ba(OH)2·8H2O与NH4Cl反应 B、 铝与稀盐酸反应
C、灼热的炭与CO2反应 D、CH4与O2燃烧反应
2、元素性质呈现周期性变化的根本原因是( )
A、元素的相对原子质量递增,量变引起质变 B、元素的原子半径呈周期性变化
C、元素原子的核外电子排布呈周期性变化 D、元素的化合价呈周期性变化
1、旨在限制发达国家温室气体排放量、抑制全球范围内气候持续变暖的《京都议定书》随着俄罗斯的加入,已于2005年2月16日正式生效。我国二氧化碳的排放量位居世界第二,为减少二氧化碳这种温室气体的排放,下列措施不切实际的是( )
A、大力开发氢能源 B、充分利用太阳能
C、不使用含碳能源 D、提高能源利用率
28、今有86g酒石酸样品,其中混有8g琥珀酸。现要将该样品用结晶法提纯酒石酸。不同温度下二者溶解度如下表(二者共存时不相互影响)
|
温度(℃) |
20 |
30 |
40 |
50 |
70 |
80 |
|
酒石酸溶解度(g) |
18 |
25 |
37 |
65 |
81 |
98 |
|
琥珀酸溶解度(g) |
7 |
11 |
16 |
36 |
51 |
71 |
(1)80℃时,溶解该样品,应加多少克水最合适(取10的整数倍)_________g。
(2)该混合液从80℃冷却到20℃时,能否析出纯酒石酸晶体?用具体数据说明原因。
(3)要使混合液尽可能多地析出纯酒石酸晶体,冷却温度最低为(取10的整数倍值)_________℃。此温度下能析出酒石酸_______g。
27、在接触法制硫酸排放的尾气,含有少量的二氧化硫。为防止污染大气,在排放前应设法进行综合利用。(本题中的气体体积均在标准状况下测定)
(1)将1m3的尾气通入100mL、4mol/L的氢氧化钠溶液使其完全反应,然后低温蒸干溶液,得到20.107g的固体(不含结晶水)。试分析所得固体的成分,以及各成分的物质的量。
(2)请计算尾气中含有二氧化硫的体积百分含量。
(3)如果该硫酸厂每小时排放这样的尾气1000m3。问用石灰乳及氧气处理后,假设硫元素损失2%,理论上可得到多少质量的熟石膏(2CaSO4·H2O)?
26、某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验。
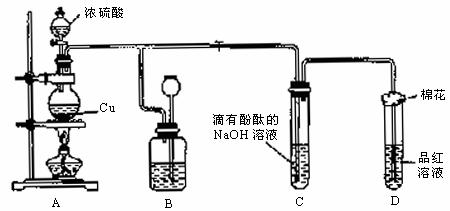
请回答下列问题:
(1)装置A中发生的化学反应的化学方程式为_______________________________;
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是_______(序号)
①水 ②酸性KMnO4 ③Na2SO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2_____________,反应的离子方程式为__________________________________________,而D中则是由于SO2具有______。
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是________,其作用是______________________________________。
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色。为了证明蓝色只与Cu2+有关,而与其他离子无关,某同学设计了下列实验,其中对实验目的没有意义的是________。(填序号)
①观察稀硫酸溶液呈无色 ②观察CuSO4粉末呈白色 ③稀释CuSO4溶液,溶液蓝色变浅 ④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色 ⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍呈蓝色
(6)若实验中用7.2g铜片和12.5mL 18.5mol/L的浓硫酸在加热条件下充分反应,最终铜片仍有剩余。根据所学的知识,某同学认为溶液中一定还有硫酸剩余,其理由是_________________________________。
25、某校活动小组用图示的装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
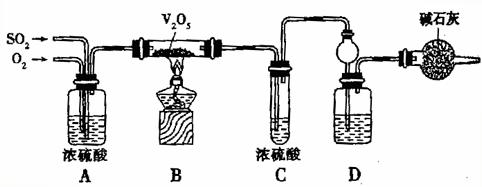
请回答下列问题:
(1)已知0.5mol SO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为____________________________;
(2)实验时装置A的作用是_________,(填序号)
①充分混合SO2和O2,②干燥作用,③通过流速控制两种气体的比例;
装置C中浓硫酸的作用为______________________________;
装置D中盛放的溶液是足量的__________(填序号)
a.BaCl2溶液 b.NaOH溶液 c.NaHSO3饱和溶液
(3)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是____________________________;
(4)实验结束,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g。若装置D增加的质量为a g,则此条件下二氧化硫的转化率是______________(用含字母的代数式表示,结果可不化简)。
(5)以上实验方法存在一个严重的漏洞,导致转化率比实际值偏小,你认为是哪一个装置中的漏洞_______,
A、A B、B C、C D、D
是什么漏洞?___________________________。
24、科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是_________;
A、同种单质 B、同位素 C、同分异构体 D、同素异形体
(2)NH4+的电子式_________;N4的结构式________;N4H44+的结构式______。
(3)已知液氨中存在着平衡2NH3 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,最后Cs+可以认为是以CsNH2的形式存在,请写出液氨与氢氧化铯反应的化学方程式:_________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,最后Cs+可以认为是以CsNH2的形式存在,请写出液氨与氢氧化铯反应的化学方程式:_________。
23、某无色溶液可能含有下列钠盐中的几种:(A)氯化钠,(B)硫化钠,(C)亚硫酸钠,(D)硫代硫酸钠(Na2S2O3+H2SO4→Na2SO4+S↓+SO2↑+H2O),(E)硫酸钠,(F)碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体生成,此气体能使硫酸铜溶液产生黑色沉淀,也能使澄清石灰水变浑浊,不能使品红溶液褪色。根据上述实验现象,回答下列问题:
(1)该气体中含有_____________(填写化学式)
(2)此无色溶液至少存在__________种钠盐,写出上述可能的情况(填写相应的化学式)。
第一种情况:___________________________________________;
第二种情况:___________________________________________;
第三种情况:___________________________________________;
第四种情况:___________________________________________;(可不填满,也可补充)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com