
题目列表(包括答案和解析)
2.形成物质世界多样性的原因有( )
①元素种类 ②同位素 ③化学键成键方式 ④同分异构现象 ⑤同素异形现象
A.仅①②③ B.仅②④⑤ C.仅①③ D.①②③④⑤
1.下列反应属于氧化还原反应,且△H>0的是( )
A.灼热的炭与CO2反应 B.Ba(OH)2·8H2O与NH4Cl反应
C.铝片与稀H2SO4反应 D.甲烷在O2中的燃烧反应
30、羧酸A和醇B(A、B中均只有一个官能团)形成的酯C,已知:①2.2g C燃烧可生成4.4gCO2和1.8g H2O;②1.76g C与50mL 0.5 mol· L-1的NaOH溶液共热后,为了中和剩余的碱液,耗去0.2 mol· L-1的盐酸25mL;③取C水解后所得的醇B 0.64g,跟足量的钠反应时,标况下收集到224mL H2。求:
(1)C的相对分子质量、分子式、结构简式。
(2)写出C与 NaOH共热反应的化学方程式:ks5*u
 2009学年第二学期温州市省一级重点中学期末统一测试
2009学年第二学期温州市省一级重点中学期末统一测试
29、已知有机物A~F有如图转化关系:
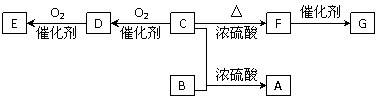
已知: ①A的分子式为C8H16O2;
②C分子中只有1个甲基;
③B、E 互为具有相同官能团的同分异构体,且均能与碳酸氢钠反应放出CO2,
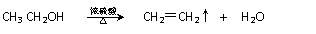 ④又已知醇在浓硫酸、加热条件下能发生以下类似的反应:
④又已知醇在浓硫酸、加热条件下能发生以下类似的反应:
⑤ F能使溴水褪色,G为高分子化合物。
请填写以下空白:
(1) C可能发生的反应有______________________ (填序号)。
①取代反应 ② 加成反应 ③加聚反应 ④氧化反应
(2) 写出E的结构简式____________________________________________。
写出F与溴的四氯化碳溶液反应生成的有机物的结构简式___________________。
(3) 写出下列转化的化学方程式。
B+C→A:_________ C→D:_________ F→G:____________
28、已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,某探究小组用KMnO4酸性溶液与H2C2O4(草酸)溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol· L-1、0.0010 mol· L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol· L-1)的用量均为2 mL。
(1) 请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
催化剂的用量 / g |
酸性KMnO4溶液的浓度/mol·L-1 |
实验目的 |
|
① |
298 |
0.5 |
0.010 |
a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和③探究温度对反应速率的影响; c. 实验①和④探究催化剂对反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
(2)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
|
实验编号 |
溶液褪色所需时间 t / min |
||
|
第1次 |
第2次 |
第3次 |
|
|
① |
14.0 |
13.0 |
11.0 |
|
② |
6.5 |
6.7 |
6.8 |
则实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。ks5*u
27、A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)写出F在周期表中的位置________。画出D的离子结构示意图___________。
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为_______________。1gA的单质与C的单质完全反应生成Y(Y为液态),放出142.9KJ的热量,请写出该反应的热化学方程式_______________________。
(3)C与F形成的常见化合物属于_________晶体。若E的单质是常见的半导体材料,则A与B形成的常见化合物R、C与D形成的常见化合物S、C与E 形成的常见化合物T, R、S、T三者的沸点从高到低排列为___________________________(写化学式)
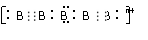 (4)画出B单质的结构式_______________。最近科学家合成出了B元素形成的B
(4)画出B单质的结构式_______________。最近科学家合成出了B元素形成的B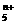 电子式
, 则n值为___ 。ks5*u
电子式
, 则n值为___ 。ks5*u
(5)A的单质与C的单质在KOH的溶液中可以形成原电池,已知M、N均为碳电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则N极的电极反应式为____________________________________。
(6)在10L的密闭容器中,通入2molFC2气体和3mol C的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol·L-1,则平衡时FC2的转化率为________。
26、淀粉和纤维素、蛋白质、脂肪是重要的营养物质,它们都能发生水解反应。
(1)蛋白质水解的最终产物中含有的官能团是(填名称) 和 。
(2)为证明淀粉已经开始水解,可在水解液中依次加入 溶液与 溶液进行检验。
(3)请写出一条方程式表示皂化反应_______________________________________
25、室温时10 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了30 mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL ,则该气态烃的分子式为
A.C4H6 B.C2H4 C.C3H8 D.C4H8
试卷Ⅱks5*u
24、有机物在反应中,常有下列原子间的共价键全部或部分断裂,如C-H、C-C、C=C、C-O、C═O等。下列各反应中,反应物分子中断裂键的排列,正确的组合是
|
化学反应 |
乙醇酯化 |
乙醇氧化 |
丙烷取代 |
乙酸酯化 |
丙烯加成 |
|
A |
O-H |
C-H |
C-H |
C-O |
C=C |
|
B |
O-H |
O-H |
C-C |
C═O |
C-H |
|
C |
C-O |
C-O |
C-H |
O-H |
C-C |
|
D |
C-O |
C-H |
C-C |
C-O |
C=C |
23、有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
|
第一组 |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
|
第二组 |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
|
第三组 |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
第四组 |
H2O 100.0 |
H2S -60.2 |
H2Se -42.0 |
H2Te -1.8 |
下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com