
题目列表(包括答案和解析)
5、( )下列事实,不能说明氯元素的非金属性比硫元素强的是
A.氯气与H2S能发生置换反应 B.HClO4酸性比H2SO4强
C.受热时,氯化氢比硫化氢稳定 D.盐酸是强酸,氢硫酸是弱酸
4、( )有关原电池的工作原理中,下列说法中不正确的是
A.电池负极发生氧化反应 B.电池正极发生还原反应
C.电子流向是从负极流向正极(外电路) D.电流方向是从负极流向正极(外电路)
3、( )我国稀土资源丰富。下列有关稀土元素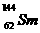 与
与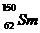 的说法正确的是
的说法正确的是
A、 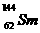 与
与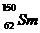 互为同位素
B、
互为同位素
B、 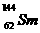 与
与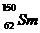 的质量数相同
的质量数相同
C、 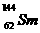 与
与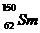 是同一种核素 D、
是同一种核素 D、
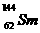 与
与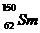 的核外电子数和中子数均为62
的核外电子数和中子数均为62
2、( )下列不属于放热反应的是
A.铝片和盐酸的反应 B.木炭、氢气、甲烷等在氧气中燃烧的反应
C.氯化铵和氢氧化钡晶体的反应 D.氧化钙和水的反应
1、( )元素的性质随原子序数的递增呈周期性变化的原因是
A.元素原子的电子层数呈周期性变化 B.元素原子的核外电子排布呈周期性变化
C.元素的化合价呈周期性变化 D.元素原子半径呈周期性变化
23.验室常用浓盐酸与二氧化锰反应来制取氯气,反应的化学方程式4HCl+MnO2== MnCl2+2H2O+Cl2↑现用密度为1.1 9g/cm3、质量分数为36.5%的浓盐酸与二氧化锰反应,生成的氯气在标准状况下的体积为5.6L。计算:
(1)浓盐酸中HCl的物质的量浓度。
(2)需要消耗二氧化锰多少克?
22.(6分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;
(2)漂白粉的有效成分是(填化学式)
;
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 ;
19.(8分)有一包白色固体粉末,可能含有Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的一种或几种,按以下步骤进行实验:(1)将固体粉末溶于水得无色溶液和白色沉淀;(2)加入稀盐酸,沉淀部分溶解且有气泡产生。根据以上实验所产生得现象,判断这种混合物里,一定含有的物质是 ,一定没有的物质是__________,可能有的物质是__________。请设计实验证明可能有的物质___________________________________________________。
20﹒(8分) 用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象可得出两条有关过氧化钠跟水反应的结论是:第一:有氧气生成;
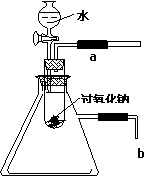 第二:
第二:
。
(2)某研究性学习小组拟用如下图所示的装置进行实验,以验证上
述结论。用以验证第一条结论的实验操作 ,
现象是
。
为了验证第二条结论,将管口b浸入水中,可观察到的现象
为 。
21﹒(8分)已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。
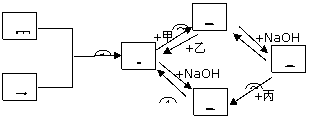
(1)写出下列物质的化学式;乙 ;B 。
(2)写出③反应的化学方程式: 。
(3)写出②反应的离子方程式: 。
18.(1) (6分)已知氯气通入热的苛性钠溶液中会发生如下反应:
3Cl2+6NaOH=5NaCl+ NaClO3+3H2O
①反应中还原剂是 (填化学式);
②把此反应改写成离子方程式: ;
③若消耗106.5gCl2,则生成的氧化产物的物质的量是 。
(2)(2分)用“双线桥”表示下列氧化还原反应中电子转移的方向和数目:
4Zn + 10HNO3(稀) ===== 4Zn(NO3)2 + NH4NO3 + 3H2O
17.实验室里需用480 mL 0.1 mol·L-1的CuSO4溶液,现选取500 mL容量瓶进行配制,以下操作正确的是( )
A 称取7.68 g硫酸铜,加入500 mL水 B 称取25.0 g CuSO4·5 H2O,配成500 mL溶液
C、称取8.0 g硫酸铜,加入500 mL水 D、称取12.5 g CuSO4·5 H2O,配成500mL溶液
第II卷(非选择题 共49分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com