
题目列表(包括答案和解析)
23.(8分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
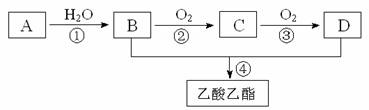
回答下列问题:
①写出A的电子式________________________。
②B、D分子中的官能团名称分别是______________、______________。
③写出下列反应的反应类型:①____________,②_____________,④______________。
④写出下列反应的化学方程式:
①______________________________________________________ ;
②_______________________________________________________;
④________________________________________________________。
22.(12分)A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍。根据上述条件,回答:
(1)元素C位于第______________周期______________族,它的最高价氧化物的化学式为______________。
(2)A是______________元素,B是______________元素,D是______________元素。
(3)A与D形成稳定的化合物的化学式为______________,判断该化合物在空气中是否变质的简单方法是______________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______________。
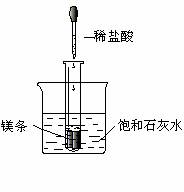
21.(8分)如下图所示,把试管放入盛有25℃时饱
和石灰水的烧杯中,试管中开始放入几小块镁
片,再用滴管滴入5 mL盐酸于试管中。试回
答下列问题:
(1)实验中观察到的现象是
_____________________________________
____________________________________。
(2)产生上述现象的原因是_________________________________________________
____________________________________________________________________。
(3)写出有关反应的离子方程式:___________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量____________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
19.(10分)将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
|
金属 |
电子流动方向 |
电压/V |
|
Fe |
Fe
→ Cu |
+0.78 |
|
Zn |
Zn
→ Cu |
+1.10 |
|
A |
Cu
→ A |
-0.15 |
|
B |
B
→ Cu |
+0.3 |
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越___________(填“大”、“小”)。
Zn、A、B三种金属活动性由强到弱的顺序是__________________________。
(2)Cu与A组成的原电池,_____为负极,此电极反应式为___________________。
(3)A、B形成合金,露置在潮湿空气中,_______先被腐蚀。
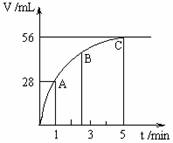 20.(8分)在50mLH2O2水溶液中加入2g二氧化锰,在
20.(8分)在50mLH2O2水溶液中加入2g二氧化锰,在
标准状况下放出气体的体积与时间的关系如图所示:
(1)该反应还可用______________代替二氧化锰做催
化剂加快反应速率。
(2)A、B、C各点所表示的反应速率由快到慢的顺序
为______________。
试解释反应速率变化的原因是_________________
__________________________________________。
 (3)该H2O2水溶液的物质的量浓度为_____________________________。
(3)该H2O2水溶液的物质的量浓度为_____________________________。
18.一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,负极电极反应式为:C2H6+18OH-→2CO32-+12H2O+14e-,下列叙述中不正确的是 ( )
A.正极发生反应是:O2+2H2O+4e-→4OH-
B.参加反应的C2H6与O2的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.在电解质溶液中阳离子向正极移动
第II卷 (非选择题 56分)
17.某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,能实现该反应的原电池组成是( )
A.正极为铁,负极为铜,电解质溶液为FeCl3溶液
B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
16.下列物质一定不是天然高分子的是 ( )
A.橡胶 B.蛋白质 C.聚乙烯 D.纤维素
15.在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有
变化,则该混合烃可能是 ( )
A.CH4和C2H4 B.CH4和C2H6 C.C2H4和C2H6 D.C3H4和C3H6
14.在理论上可用于设计原电池的化学反应是 ( )
A.2Al(s)+2NaOH(aq)+2H2O(1) = 2NaAlO2(ag)+3H2(g) △H <0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) △H >0
C.CaC2(s)+2H2O(1) = Ca(OH)2(s)+C2H2(g) △H <0
D.HCl(aq)+NaOH(aq) = NaCl(aq) + 3H2O(l) △H <0
13.右图中a、b、c、d、e为周期表前4周期的一部分,下列叙述正确的是 ( )
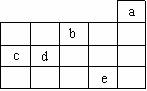 A.b元素除0价外,只有一种化合价
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素形成的单质性质最稳定
C.c、d元素最高价氧化物的水化物酸性:c > d
D.e元素在自然界中主要存在于海水中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com