
题目列表(包括答案和解析)
8.下列反应中硫酸只表现氧化性,不表现酸性的是
A.2H2SO4(浓)+Cu CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
B.2H2SO4(浓)十C CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
C.H2SO4(浓)+NaCl NaHSO4+HCl↑
NaHSO4+HCl↑
D.H2SO4+Na2SO3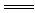 Na2SO4+H2O+SO2↑
Na2SO4+H2O+SO2↑
7.下列离子型化合物,其中A离子和B离子的电子层结构相同,A原子的最外层电子数比B原子的最外层电子数少4个,而次外层电子数则是A比B多6个,则该离子化合物可能是
A.MgO B.CaO C.KF D.Na2O
6.某溶液中有Fe2+、Mg2+、Al3+、Fe3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,,溶液中大量减少的阳离子是
A.Fe2+ B.Mg2+ C.Al3+ D.Fe3+
5.下列比较不正确的是
A.酸性:H2SO4>H3PO4 B.碱性:KOH>NaOH
C.原子半径:S<Cl D.稳定性:NH3>CH4
4.关于元素周期表和元素周期律的应用有如下叙述:
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料。其中正确的是:
A.①②③④ B.只有②③④ C.只有③④ D.只有②③
3.某主族元素R的最高正价与最低负化合价的代数和为6,由此可以判断
A.R可能是第二周期元素
B.R一定是ⅥA族元素
C.R的气态氢化物比同周期其他元素气态氢化物稳定
D.R气态氢化物化学式为H2R
2.下列物质中既能与稀H2SO4反应, 又能与NaOH溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3
A.③④ B.①②③④ C.①③④ D.全部
1.美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118、质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为
A.47 B.57 C.61 D.175
30. (13分)
I. 实验室里用二氧化锰和浓盐酸加热制取氯气,该反应的离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O,也可以利用反应
Mn2++Cl2↑+2H2O,也可以利用反应
2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O制取并收集纯净、干燥的氯气,部分装置如图所示:

(1)若以KMnO4和浓盐酸为原料制取氯气,请根据反应原理从下图中选择合适的制气装置 (填代号)。

(2)装置B的作用是 。
(3)E中的试剂可选用 (填代号)。
A.NaOH溶液 B.Na2CO3溶液 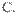 NaCl溶液 D.水
NaCl溶液 D.水
(4)某学生通过下列两种方式制取氯气:
①用8.7gMnO2与足量浓盐酸反应制取Cl2
②用含14.6gHCl的浓盐酸与足量MnO2反应制取Cl2这两种方式产生Cl2的量的关系是 。
A.①多 B.②多 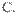 ①②一样多
①②一样多
 II.现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
II.现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
(1)写出发生反应的离子方程式 ;
(2)实验过程中绘制出生成CO2的体积[V(CO2)]与时间(t)的关系如图所示,试分析判断OE段、EF段、FG段反应速率[分别用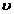 (OE)、
(OE)、 (EF)、
(EF)、 (FG)表示]的大小关系
。
(FG)表示]的大小关系
。
(3)为k!s#5^u了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
A.蒸馏水 B.氯化钠固体  氯化钠溶液 D.浓盐酸
氯化钠溶液 D.浓盐酸
29. (16分) A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程: 。
(3)写出A、B两元素的最高价氧化物的水化物之间的相互反应的离子方程式: 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com