
题目列表(包括答案和解析)
6、质量数是37的原子,可能有( B )。
A、19个质子,18个中子,20个电子。
B、18个质子,19个中子,18个电子。
C、19个质子,18个中子,18个电子。
D、17个质子,20个中子,18个电子。
5、下列说法中,错误的是( )
A、氯离子的电子层结构跟氩原子相同
B、氯离子、氯原子都是氯元素
C、氯气有毒,有剧烈的刺激性
D、氯元素呈黄绿色
4、下列说法中,正确的是( )。
A、2 H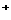 就是质子。
就是质子。
B、13C的原子中有6个质子、7个中子和6个电子。
C、人们已经知道了107种元素,即人们已知道了107种原子。
D、原子不显电性,是因为原子是由不带电的微粒构成的。
3、下列各组微粒中,互为同位素的是( )。
A、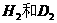 B、
B、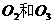 C、1 H和2 H D、40 Ca和40 K
C、1 H和2 H D、40 Ca和40 K
2、汤姆孙提出原子的葡萄干面包模型的主要依据是( )。
①原子构成中有电子②原子构成中有质子③原子构成中有中子④整个原子是电中性的
A、③ B、①② C、②④ D、①②④
1、国际元素相对原子质量表上查得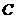 是12.01,这是指碳的( )。
是12.01,这是指碳的( )。
A、质量数 B、相对原子质量 C、同位素相对原子质量 D、平均相对原子质量
30.(4分)某元素的同位素 X,它的氯化物XCl21.11溶于水制成溶液后,加入1mol/L的NaOH溶液20mL恰后完全反应。若这种同位素原子核内有20个中子,求:
X,它的氯化物XCl21.11溶于水制成溶液后,加入1mol/L的NaOH溶液20mL恰后完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值和A值
(2)X元素在周期表中的位置
|
29.(3分)某工厂的燃料煤中硫的质量分数为0.32%,该工厂每天燃烧这种煤50吨。计算:
(1)如果煤中的硫全部转化为SO2,每天可生产的SO2的质量;
(2)这些SO2在标准状况下的体积。
28.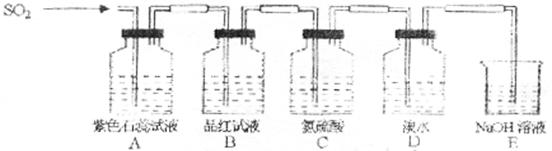 已知在溶液中Cl2可氧化SO2:Cl2+SO2+2H2O=2HCl+H2SO4。下图是有关SO2性质的实验装置,试回答下列问题:
已知在溶液中Cl2可氧化SO2:Cl2+SO2+2H2O=2HCl+H2SO4。下图是有关SO2性质的实验装置,试回答下列问题:
(1)A、B、C、D四个装置中发生的现象分别是______________、______________、
______________、______________。
(2)SO2具有下列性质:①漂白性 ②酸性氧化物的性质 ③还原性 ④氧化性。在图中几个装置中SO2表现的性质依次是:A中______、B中______、C中______、D中___ ___。
(3)实验完毕后,取B中溶液少许于试管中加热,发生的现象是_______________,其原因是__________________________________________。
(4)实验完毕后,取D中溶液少许于试管中,加入BaCl2溶液和稀盐酸,现象是________。
(5)E中发生的反应的离子方程式为_________________________。
27.(共5分)有A、B、C、D、E的四种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4gC与足量热水反应时,在标准状况下放出氢气2.24L。D原子的核内质子数比C多一个。E原子的M层上有7个电子。
(1) 写出A、B、C、D、E的元素名称及元素符号
(2) 写出B、C、D、E最高价氧化物对应水化物的化学式试比较它们的酸碱性,并写出B、D最高价氧化物对应水化物反应的化学方程式和离子方程式
(3) 比较E的气态氢化物与H2S和HF的稳定性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com