
题目列表(包括答案和解析)
5.按Li、Na、 K、Rb、Cs顺序递增的性质是( )
A、单质的还原性 B、阳离子的氧化性
C、单质的密度 D、单质的熔点
4.下列说法错误的是( )
A、H、D、H+和H2是氢的四种不同粒子
B、12C和13C、石墨与金刚石均为同位素
C、H和D是不同的核素
D、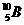 和
和 互为同位素,物理性质不同,化学性质几乎完全相同
互为同位素,物理性质不同,化学性质几乎完全相同
3.下列关于卤族元素的说法中,不正确的是( )
A、单质的熔点和沸点随核电荷数的增加逐渐升高
B、单质的颜色随核电荷数的增加逐渐加深
C、单质的氧化性随核电荷数的增加逐渐增强
D、氢化物的稳定性随核电荷数的增加逐渐减弱
2.某元素R原子的最外层电子数是次外层电子数的3倍,则对该元素的判断正确的是( )
A、处于第三周期ⅵA族 B、最高正化合价为+6
C、氢化物的化学式为H2R D、最高价氧化物水化物的化学式为H2RO4
1.下列原子序数所代表的元素中,全部属于主族元素的是( )
A、22 、26、 11 B、13 、15 、35 C、9、36 、16 D、18 、12 、14
25、(12分)在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是 (填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为 。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确? ,
其理由是 。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W D.2 molX、1mol Y、1molZ
(5) X的转化率α= (用含Q、Q1的代数式表示)。
24、(4分)已知t℃,p KPa时,在容积为V L的密闭容器内充有1molA和1molB。保持恒温恒压,使反应A(g)+B(g) C(g)达到平衡时,A的体积分数为40%。试回答有关问题:
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2molA和2molB,则反应达到平衡时,容器的容积为 。
(2)若另选一容积固定不变的密闭容器,仍控制温度为t℃,使1molA和1molB反应达到平衡状态时,A的体积分数仍为40%,则该密闭容器的容积为 。
23、(每空2分,共12分)
可逆反应Fe(s)+CO2(g) FeO(s)+CO(g),在温度938K时,平衡常数K=1.47,
在1173K时,K=2.15
(1)写出该反应的平衡常数表达式____________________
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件再达平衡后(选填“增大”、“减小”、“不变”)
①升高温度,CO2的平衡浓度__________,
②再通入CO2,CO2的转化率___________,
③增大容器的体积,混和气体的平均分子量_________。
(3)该反应的逆反应速率随时间变化
 情况如图:
情况如图:
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是_______________(填序号, 答案可能不止一个)
a. 升温 b. 增大CO2的浓度
c. 使用催化剂 d. 增压
②如果在t3时再增加CO2的量,t4时反应又处于新平衡状态,请在图上画出t3-t5时间段的v逆变化曲线。
22、(每空2分)有pH = 1的盐酸、硫酸和醋酸溶液:(用“〉”、“〈”或“=”表示)
(1)设三种溶液的物质的量浓度分别为a、b、c,则其关系是 ,
(2)同体积的三种酸与足量的NaOH完全反应生成的盐的物质的量分别为a、b、c,则它们的关系是
(3)完全中和体积和物质的量浓度都相同的NaOH溶液时,需三种酸的体积分别为a、b、c,则它们的关系是
21、(6分)将等物质的量的A、B、C、D四种物质混合,发生如下反应:
a A + b B c C + d D ,当反应进行一定时间后,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol,此时达到化学平衡。
(1)该化学方程式各物质的化学计量数为:
a = b = c = d =
(2)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为 反应(填“放热”或“吸热”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com