
题目列表(包括答案和解析)
1.已知Ra(镭)是第七周期ⅡA族元素,原子序数为88。它是居里夫妇首先发现的一种元素。有关它的性质推断不正确的是( )
A.镭单质很活泼,可与冷水反应 B.它的硫酸盐可能难溶于水
C.镭单质的硬度,熔沸点都比镁单质的高 D.镭元素具有放射性
24、(11分)已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E形成4核10电子分子。试回答下列问题:
(1) C位于元素周期表中第________周期________族 ;A的原子结构示意图为___________________。
(2) 用电子式表示离子化合物A2B的形成过程______________________________________。
(3) 写出D元素形成单质的结构式____________,A、B、E形成化合物的电子式________________。
(4) A、B两元素组成化合物A2B2属于_________(“离子”“共价”)化合物,存在的化学键是___________________,写出A2B2与水反应的化学方程式_________________________。
25 (8分)氢氧燃料电池是符合绿色化学理念
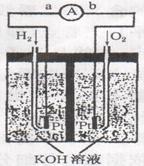 的新型发电装置.下图为电池示意图,该电池电
的新型发电装置.下图为电池示意图,该电池电
极表面镀一层细小的铂粉,铂吸附气体的能力
强,性质稳定.请回答下列问题:
(1) 氢氧燃料电池的能量转化主要形式是____________________,在导线中电子流动方向为_________________(用a、b表示)。
(2)负极的电极反应式为____________________________________。
(3)电极表面镀铂粉的原因为______________________________ 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸收和放氢原理如下:
I、2Li+H2=2LiH
II、LiH+H2O=LiOH+H2↑
①反应I中的还原剂是_____________,反应中II的氧化剂是______________。
②已知用锂吸收224L(标准状况)H2,生成的LiH再与H2O作用,放出的H2用作电池燃料,若能量的转化率为80%,则导线中通过电子的物质的量为_____


|

|
 版权所有:()
版权所有:()
版权所有:()
版权所有:()

23、(8分)向体积为2L的密闭容器中加入2molSO2和1molO2,进行可逆反应: 催化剂
2SO2+O2 2SO3
反应2min后,测得O2的物质的量为0.8mol,则加热
2SO3
反应2min后,测得O2的物质的量为0.8mol,则加热

 (1)2min内,SO2的物质的量减少了
SO3的物质的量增加了
(1)2min内,SO2的物质的量减少了
SO3的物质的量增加了
 (2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= __________
(4)2min时SO2的转化率是____________
22、 (7分)如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
(7分)如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
(1)实验中观察到的现象是
(2)产生该现象的原因
(3)写出有关反应的离子反应方程式
(4)有此推知,MgCl2溶等于液和H2的总能量 填 (“大于”“小于”或“”)镁片和盐酸的总能量
21、(6分)在下列事实中,请填写出是什么因素影响了化学反应的速率:
(1)
 熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体
熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体
(2) 将食物放入冰箱中保鲜,不易腐烂
(3)

 同样大小的锌粒分别与0.1mol/LHCl和1mol/LHCl反应,反应速率不同
同样大小的锌粒分别与0.1mol/LHCl和1mol/LHCl反应,反应速率不同
20.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )
|
X |
Y |
|
|
|
Z |
W |
A、原子半径:W >Z >Y >X
B、最高价氧化物对应水化物的酸性:Z>W>X
C、Y的氢化物在常温下为气态
D、W的单质能与水反应,生成一种具有漂白性的物质
19.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3 + H2SO4= Na2SO4+ SO2↑+ S↓ +H2O ,下列各组实验中最先出现浑浊的是:( )
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
C/(mol.L-1) |
V/mL |
C/(mol.L-1) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
18.某元素一种同位素原子的质子数为m,中子数为n,则下列论断正确的是( )
A、不能由此确定该元素的相对原子质量
B、这种元素的相对原子质量为m+n
C、若碳原子质量为Wg,此原子的质量为(m+n)Wg
D、核内中子的总质量小于质子的总质量
17.在反应A(s)+B(g)=2C(g)中,可使反应速率增大的措施是( )
①增大压强 ②升高温度 ③通人B气体 ④ 增加A的量 ⑤降低压强
A、①②③④ B、②③④⑤ C、①②③ D、②③④
16.对于化学反应的限度的叙述,错误的是( )
A、任何可逆反应都有一定的限度
B、化学反应达到限度时,正逆反应速率相等
C、化学反应的限度与时间的长短无关
D、化学反应的限度是不可改变的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com