
题目列表(包括答案和解析)
15.将0.6 mol
A和0.5 mol
B充入0.4L密闭容器中发生2A(g)+B(g) 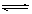 mD(g)+E(g),经
mD(g)+E(g),经
过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速
率为0.1 mol·L-1·min-1,下列结论正确的是( )
A.A、B的转化率均为20% 教育博客 B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1教育博客
D.平衡时混合物总物质的量为1 mol
14.下列实验不能作为判断依据的是( )
A.钠和镁分别与冷水反应,判断钠和镁金属性强弱教育博客
B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱
C.碳酸钠溶液中通入SO2产生气泡,判断碳与硫的非金属性强弱教育博客
D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱教育博客
13.目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属
元素的判断不正确的是( )
① 都是主族元素,原子的最外层电子数都大于3;
②单质在反应中都只能作氧化剂;
③对应的含氧酸都是强酸;④氢化物常温下都是气态,所以又叫气态氢化物;今日必看
⑤气态氧化物与水反应都不会再生成气体
A.全部 B.只有①② C.只有①②③④ D.只有①②④⑤
12.关于原子序数为33的元素砷,下列说法不正确的是( )
A.元素砷在周期表中的位置为第四周期第VA族
B.砷原子的第3电子层含有8个电子
C.砷可以有-3、+3、+5等多种化合价
D.砷的氢化物的稳定性比磷化氢的强
11.短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19, W
和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8。下列说法不正确
的是( )
A.与W相邻的同主族元素可制成重要的半导体材料
B.元素原子半径从大到小的顺序是X、Y、Z
C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4
10.在无色透明强酸性溶液中,能大量共存的离子组是( )
A.K+、Cu2+、NO3-、SO42- B. K+、Na+、Cl-、SO42-
C.Zn2+、NH4+、NO3-、Cl- D. K+、Na+、MnO4-、CO32-
9.下列离子方程式书写正确的是( )
A.氯气和水的反应: C12+H2O=2H++C1-+ClO-
B.稀硝酸与过量的铁屑反应 : 3Fe+8H++2NO3- = 3Fe3++2NO↑+4H2O
C.铝跟氢氧化钠溶液反应:2Al + 2H2O + 2OH-= 2 AlO2- + 3H2↑
D.三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体: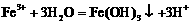
8.下列说法合理的是( )
①KMnO4和H2S不能一起存放;②取用化学试剂不能用手直接去取;
③不能直接用鼻子闻SO2的气味;④点燃H2前要验纯;
⑤用蒸馏烧瓶加热液体要放碎瓷片;⑥有加热和洗气装置的实验要防止倒吸;
⑦稀释浓硫酸时要使水沿器壁慢慢流入硫酸中
A.①②④⑤⑥ B.①③④⑤⑥⑦ C.①②③④⑤⑥ D.②③④⑤⑥⑦
7.下列叙述正确的是 ( )
A.3Li+中含有的中子数与电子数之比为4∶3
B.离子化合物中只含有离子键
C.常温下,11.2L的甲烷气体中含有碳氢键的物质的量为2mol
D.常温下,可用铁制的容器来盛装浓硝酸或浓硫酸
6. 中子数比质子数多1个的原子A,其阳离子An+ 核外有X个电子,则A的质量数为( )
A.2(x+n) B.2(x-n)+1 C.2(x +n)+1 D.n+2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com