
题目列表(包括答案和解析)
2.低碳经济谋求低能耗、低排放、低污染。发展低碳经济,应大力开发
A.煤炭 B.氢能 C.天然气 D.太阳能
1.据科学家推测,月球的土壤吸附着数百万吨的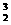 He;在地球上,氦元素主要以
He;在地球上,氦元素主要以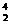 He的形式存在。
He的形式存在。
下列有关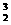 He和
He和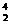 He的说法正确的是
He的说法正确的是
A.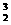 He和
He和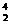 He互为同位素
He互为同位素
B.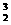 He和
He和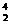 He属于同一种核素
He属于同一种核素
C.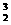 He和
He和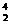 He都具有相同的质量数
He都具有相同的质量数
D.He原子最外层2个电子,在化合物中显+2价
25.(16分)A-F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性。F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末。这些物质之间满足如图所示的转化关系,图中部分生成物已略去。
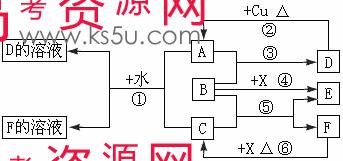
(1)写出下列物质的化学式:A ,F 。
(2)B的电子式为 。根据图中信息,B、C、X的氧化性由强到弱的顺序是 (用化学式表示)。
(3)写出反应①的离子方程式 ;
写出反应⑥的离子方程式 。
(4)在反应⑥中,F表现的性质是 ,当生成0.75 mol C时,被氧化的还原剂的物质的量是 。
2010年重庆一中高2012级期末考试
24.(14分)亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到。亚硝酰氯有关性质如下:
|
分子式 |
别名 |
熔点 |
沸点 |
溶解性 |
性状 |
|
ClNO |
氯化亚硝酰 |
-64.5℃ |
-5.5℃ |
溶于浓硫酸 |
红褐色液体或有毒气体,具有刺激恶臭,遇水反应生成氮的氧化物与氯化氢 |
某研究性学习小组根据亚硝酰氯性质拟在通风橱中制取亚硝酰氯,设计了如图所示实验装置。实验开始前K2处于打开状态,K1、K3均已关闭。、

试回答下列问题:
(1)①若D中装有纯净的NO气体,则B中应选用的试剂为 。实验时利用B除去某些杂质气体并通过观察B中的气泡来判断反应速率,B还具有的作用是 ;②若D中装有纯净的氯气,则C中应选用的试剂为 。
(2)装置F的作用是 ;装置G的作用是 。
(3)若无装置G,则F中ClNO可能发生反应的化学方程式为 。
(4)某同学认为氢氧化钠溶液只能吸收氯气和ClNO,但不能吸收NO,所以装置H不能有效除去有毒气体。为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是 。
23.(原创)(12分)硫酸被人们誉为“化学工业之母”,在国民生产中发挥着重要作用,硫酸的产量是衡量一个国家化学工业水平的标志。工业上生产硫酸包括三步:
(1)第一步,在沸腾炉中煅烧黄铁矿,反应如下:4FeS2+11O2 8SO2+2Fe2O3,该反应的氧化产物是
,当生成8 mol SO2时转移电子的物质的量为 。
8SO2+2Fe2O3,该反应的氧化产物是
,当生成8 mol SO2时转移电子的物质的量为 。
(2)第二步,在接触室中发生如下反应:2SO2+O2  2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1 α2(填“大于”、“等于”或“小于”)。
2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1 α2(填“大于”、“等于”或“小于”)。
(3)第三步,在吸收塔中将SO3转化成硫酸。硫酸是化学实验中的常用试剂:
①浓硫酸可以与多种物质发生化学反应,试写出浓硫酸与铜发生反应的化学方程式 。
②有Na、Mg、Al、Cu四种金属,若两两混合后取混合物14 g与足量稀硫酸反应,产生标准状况下H2 5.6 L,则此混和物的组合方式最多有 种。
22.(12分)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如下图所示。
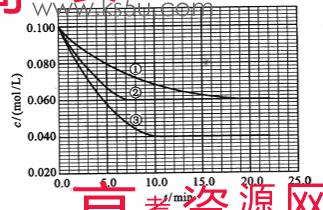
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件是:②_______________;③_______________。
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________。
(3)该反应的正反应是 (填“放热”或“吸热”)反应。
(4)实验③前10.0 min内平均反应速度率vB=__________________。
21.(16分)D、E、X、Y、Z是短周期元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1) D和X形成的化合物中的化学键类型是_______________;D和Y形成的分子是_________(填“极性”或“非极性”)分子。
(2)Y和Z的简单离子的半径大小为__________(用离子符号和“>”、“=”或“<”表示)。
(3)比较元素非金属性的强弱有很多方法,关于D和X的非金属性强弱的研究方案中不可行的是_________(填序号)。
①比较氢化物的稳定性 ②依据两元素在周期表的位置 ③比较两种单质的颜色
④比较单质与H2化合的难易程度 ⑤比较最高价氧化物对应水化物的酸性
(4)当满足一定比例时,Z的单质可与E的最简单氢化物反应生成一种盐和另一种单质,试写出该反应的化学方程式________________________。
(5)写出下列反应的化学方程式:
①工业上用D的单质制X的单质___________________________________;
②E的最高价含氧酸的浓溶液与单质D反应__________________________。
(6)E有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则生成的E的含氧酸盐的化学式是__________。
20.标准状况下V L氨气溶解在1 L水中(水的密度为1 g/mL),所得溶液的密度为ρg/mL、溶质质量分数为ω、物质的量浓度为c mol/L,则下列关系中不正确的是
A.ρ=(17V+22400)/ (22.4+22.4V) B.ω=17c / (1000ρ)
C.ω=17 V /(17V+22400) D. c=1000Vρ/(17V+22400)
第Ⅱ部分(非选择题,共70分)
19.短周期金属元素甲-戊在元素周期表中的相对位置如右表所
示,下面判断正确的是
A.原子半径:丙<丁<戊 B.金属性:甲>丙
C.最外层电子数:甲>乙 D.氢氧化物碱性:丙>丁>戊
18.下列关于元素周期表的说法不正确的是
A.元素周期表中一共有16个纵行
B.除零族元素外,非金属元素全都是主族元素
C.同周期ⅡA族与ⅢA族元素的原子序数之差可能为25
|
甲 |
乙 |
|
|
丙 |
丁 |
戊 |
D.同族上下相邻两种元素的原子序数之差可能为32
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com