
题目列表(包括答案和解析)
16.在一密闭容器中进行如下反应2SO2(g)+O2(g)
 2SO3(g)测得某一时刻SO2 、O2 、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
2SO3(g)测得某一时刻SO2 、O2 、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
A 、SO2 、O2浓度分别为0.4mol/L、0.2mol/L
B、 SO3浓度为0.25mol/L
C、SO3浓度为0.4mol/L
D、SO3、 SO2浓度均为0.15mol/L
15. 短周期元素、X、Y、Z在周期表中的位置关系如图所示,
下列说法中正确的是 ( )
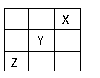 A Z一定是活泼金属
A Z一定是活泼金属
B Z的单质能溶于热的烧碱溶液
C 1molY的单质跟足量水反应时,转移的电子数是4mol
D X的最高价氧化物对应的水化物是一种强酸
14. 某主族元素R的第五电子层上只有一个电子,下列描述正确的是( )
A 其单质在常温下跟水的反应不如钠剧烈 B 其原子半径比钾离子半径小
C 其碳酸盐易溶于水 D 其氢氧化物不能使氧化铝溶解
13. X、Y、Z三种元素的核电荷数在10-20之间,它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A 元素的得电子能力:X<Y<Z B气态氢化物的稳定性:按X、Y、Z顺序变大
C含氧酸的酸性: H3ZO4>H2YO4>HXO4 D元素负化合价的绝对值:按X、Y、Z顺序变大
12.在一定温度下,容器内某一反应中 M 、N 的物质的量随反应时间变化的曲线如右图,下列表述中正确的是( )
A .反应的化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N 的浓度是 M 浓度的 2倍
11.X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层数相同;Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素的原子序数关系为( )
 A
X>Y>Z
B Y>X>Z
C Z>X>Y D Z>Y>X
A
X>Y>Z
B Y>X>Z
C Z>X>Y D Z>Y>X
10. A元素的最高正化合价和负化合价的绝对值之差为6,B元素和A元素的原子次外层上的电子数均为8,A与B可形成化合物BA2,则该化合物是( )
A MgCl2 B CaF2 C SiO2 D CS2
9. 对于达到平衡状态的可逆反应:N2 +3H2
 2NH3 ,下列有关叙述正确的是
2NH3 ,下列有关叙述正确的是
A.反应物和生成物浓度不再发生变化
B.反应物和生成物的浓度相等
C.N2和NH3的质量分数相等
D.正反应和逆反应不再进行
8.下列性质中,可以证明某化合物内一定存在离子键的是( )。
 A. 可溶于水
B. 具有较高的熔点
A. 可溶于水
B. 具有较高的熔点
C. 熔融状态能导电 D. 水溶液能导电
7.共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436kJ/mol,H-Cl键的键能是431 kJ/mol,Cl-Cl键的键能是247 kJ/mol,H2和Cl2反应生成1molHCl放出的热量是( )
A 431kJ B179kJ C 89.5kJ D以上说法都不对
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com