
题目列表(包括答案和解析)
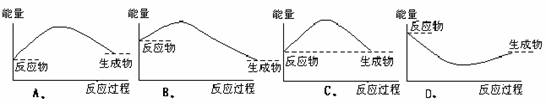
2.下列各图中,表示正反应是吸热反应的是 ( )
1.下列过程中,共价键被破坏的是 ( )
A.碘升华 B.溴蒸气被木炭吸附
C.酒精溶于水 D.HCl气体溶于水
30.(13分)某兴趣小组在研究性学习中设计了如下实验来探究Fe和H2SO4反应的过程,装置如下图所示。
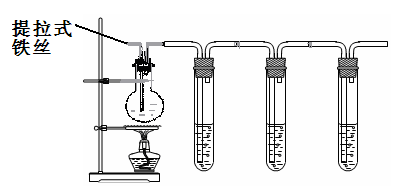

①在烧瓶中加入浓硫酸。
②将提拉式铁丝插入溶液中,观察到有少量气泡,后停止的现象。
③加热烧瓶至有大量气体产生时停止加热,品红溶液颜色褪去,烧瓶中溶液变为棕黄色。
④一段时间后KMnO4溶液颜色不再变浅,但NaOH 溶液中仍有气体放出,在导管口处可点燃此气体,烧瓶中液体变为浅绿色
根据以上实验回答:
(1) 由步骤②的现象可得出的结论是:
(2) 在步骤③中,品红溶液褪色的原因是
(3) 写出步骤④中,使溶液变为浅绿色的可能的原因是(用离子方程式表示)
(4) 若1g氢气燃烧生成液态水放出142.9KJ热量,则氢气的燃烧热的热化学方程式是:
(5) 若在反应中铁丝质量减少a克,并收集到bL可燃性气体(标准状况下假设无体积损失),则在反应过程中产生的使品红溶液褪色的气体的质量是
(用含a、b数学表达式表示)
29. (10分)将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
|
金属 |
电极 |
电压/V |
|
Fe |
Fe
→ Cu |
+0.78 |
|
Zn |
Zn → Cu |
+1.10 |
|
A |
Cu → A |
-0.15 |
|
B |
B → Cu |
+0.3 |
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越 (填“大”、“小”)。
Zn、A、B三种金属活动性由强到弱的顺序是 。
(2)Cu与A组成的原电池, 为负极,此电极反应式为(失去电子数用ne-
表示 。
(3)A、B形成合金,露置在潮湿空气中, 先被腐蚀。
28.(10分) A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,乙物质的电子式是
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)
。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是 。
(4)简述比较D与E金属性强弱的实验方法:
。
26.(3分)(1)如图所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面人低于b端液面的是____________。(填序号)
27(14分)拆开1 mol H-H键,1 mol N-H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1 mol N2生成NH3___________热量(填:“吸收”或“放出”) _______kJ;1 mol H2生成NH3___________热量(填:“吸收”或“放出”) _______kJ;理论上,每生成1 mol NH3,_________热量(填:“吸收”或“放出”)_________kJ;事实上,反应的热量总小于理论值,理由是_______________________。
25.下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙
述正确的是
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.089 |
0.102 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物具有两性
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q<L
 第II卷 非选择题共50分
第II卷 非选择题共50分
24.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
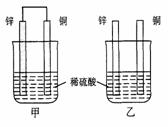 B.甲中铜片是正极,乙中铜片是负极
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
23.x、y的原子序数均小于18,x原子K、L、M各电子层的电子数之比为1:4:1,它比y原子多3个电子,下列叙述正确的是
A.x离子半径大于y离子半径
B.y的单质与水反应可生成使带火星的木条复燃的气体
C.x原子半径大于y原子半径
D.x、y形成的化合物的摩尔质量为62
22.已知氢化锂(LiH)属于离子化合物,氢化锂跟水反应可以放出H2,下列叙述中正确的是
A、LiH的水溶液显中性
B、LiH是一种强氧化剂
C、LiH中的氢离子可以被还原成H2
D、LiH中的氢离子与锂离子的核外电子排布相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com