
题目列表(包括答案和解析)
16、在标准状况下,O210g含n个分子,则阿佛加德罗常数约为___________。
(二)本题共10小题,每小题3分,共30分。每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的选对一个给1分,选错一个该小题不给分。
6、把9.2g钠和4.2g硅投入一盛水容器中,在标准状况下,产生的H2的体积是
A.2.8L B.5.6L C.11.2L D.22.4L
7、 (CN)2、(SCN)2……称为类卤素,CN-、OCN-、SCN-……称为类卤离子,下列关于(CN)2的反应中哪一种不象卤素的反应
(CN)2、(SCN)2……称为类卤素,CN-、OCN-、SCN-……称为类卤离子,下列关于(CN)2的反应中哪一种不象卤素的反应
A.在碱液中生成CN-和OCN- B.可以在空气中燃烧
C.与卤素反应生成CNCl、CNBr D.与银、汞、铅反应得难溶盐
8、向含amolCa(OH)2的澄清石灰水(未饱和)中通入bmolCO2,充分反应后,下列判断正确的是
A.当a³b时,产生amol沉淀
B.当a£b时,产生bmol沉淀
C.当a<b<2a时,产生(2a-b)mol沉淀
D.当2a<b时, 溶液仍澄清
9、设NA表示阿佛加德罗常数,下列叙述正确的是
A.22.4L氘(D2)气体,含有中子数为2 NA
B.1.6gNH2-离子所含电子数为NA
C.4g氦气所含分子数为NA
D.在60gSiO2晶体中,含有2 NA个Si-O键
10、X、Y是除第一周期外的短周期元素,它们可以形成离子化合物XmYn,且离子均具有稀有气体原子的结构,若X的原子序数为a,则Y的核电荷数不可能是
A.a+16-m-n B.a+8-(m+n)
C.a-8+(m+n) D.a-m-n
11、在一定温度下,对于难溶盐MA,其饱和溶液中的M+和A-的物质的量浓度之间存在关系:[M+][A-]=Ksp(常数),现将足量的AgCl分别放在5mLH2O、10mL0.2mol/LMgCl2、20mL0.5mol/LNaCl和40mL0.3mol/L盐酸溶液中溶解达到饱和,各溶液中Ag+浓度数值依次为a、b、c、d,则它们之间大小顺序为
A.a>d>c>b B.a>d>b=c
C.d>b>c>a D.a>d>b>c
12、在常温常压下,将aLSO2和bLH2S混合,当反应后气体体积是反应前气体体积的四分之一时,则a与b之比为
A.1:1 B.1:2 C.1:3 D.1:4
13、某K2CO3样品中含有Na2CO3、KNO3、Ba(NO3)2三种杂质中的一种或两种。现将13.8g样品加入足量水,样品全部溶解。再加入过量的CaCl2溶液,得到9g沉淀。对样品所含杂质的正确判断是
A.肯定有KNO3、肯定无Na2CO3
B.肯定有KNO3可能还含有Na2CO3
C.肯定没有Ba(NO3)2、可能有KNO3
D.肯定没有Na2CO3和Ba(NO3)2
14、已知35% NaOH溶液的密度为1.38g.cm-3,5% NaOH溶液的密度为1.05 g.cm-3,若将上述两种溶液等体积混合,所得NaOH溶液的质量分数是
A.大于20% B.等于20% C.小于20% D.无法估算
15、铁有可变化合价,将14.4g草酸亚铁(FeC2O4)与空气隔绝加热分解,最终得到7.2g铁的氧化物,则该铁的氧化物是
A.FeO B.Fe2O3 C.Fe3O4 D.FeO、Fe3O4
高&考%资*源#网
高&考%资*源#网
请把选择题答案填入下面的表格中
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
13 |
14 |
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
高&考%资*源#网 |
(一)本题共5小题,每小题只有一个选项符合题意,共15分。
1、“绿色商品”是指对环境无污染的商品,下列属于“绿色商品”的是
A.含碘食盐 B.含磷洗涤剂 C.含铅汽油 D.含氟冰箱
2、硝酸铜受热时可发生分解反应,有关反应的化学方程式为:2Cu(NO3)2=2CuO+4NO2↑+O2↑。已知带火星的木条在空气中不能复燃,但伸进硝酸铜分解产生的混合气体中,木条能复燃,以上事实可以说明
A.NO2具有氧化性 B.NO2具有还原性
C.NO2不发生反应 D.只有O2才能助燃
3、同温同压下,等体积的两容器中,分别充满由14N、13C、18O三种原子构成的NO和CO。下列说法正确的是
A.所含分子数和质量均不相同 B.含有相同的中子和质子
C.含有相同数目的中子、原子和分子 D.含有相同分子数和电子数
4、a、b、c、d是四种短周期元素,a、b元素的阳离子和c、d两元素的阴离子都是具有相同的电子层结构,且a的阳离子的氧化性比b的阳离子氧化性弱, c的阴离子所带的电荷比d的阴离子所带的电荷多,则它们的原子序数大小关系为
A.b>a>d>c B.c>b>a>d
C.a>b>c>d D.b>a>c>d
5、对于反应H- + NH3=H2 + NH2-的不正确的说法是
A.属于置换反应
B.H-是还原剂
C.H2既是氧化产物又是还原产物
D.氧化产物与还原产物的化学计量数之比为1:1
31.(10分)选作题
请将6种物质: N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3 H2O分别填入下面对应的横线上,组成一个未配平的化学方程式:
(1) 方程式为:
+ → + + +
(2) 反应物中发生氧化反应的物质是 ,被还原的元素是 。
(3) 反应中1mol氧化剂发生还原时转移电子数为 mol
(4) 配平后的系数填入下列相应的空格上
30.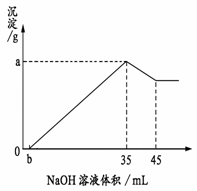 (6分)取6 g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。 试求:
(6分)取6 g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。 试求:
(1).Ob段反应的离子方程式为:
(2).硫酸溶液的物质的量浓度为 。
(3) 若b = 2.0,则铝土矿中氧化铁的质量分数是
29.(13分)合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为
测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验
方案进行探究。填写下列空白。
[实验方案一]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。实验中发生反
应的化学方程式是
[实验步骤]
(1)称取5.4 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”、“偏低”或“无影响”)。
[实验方案二]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 105Pa)的体积。
105Pa)的体积。
[问题讨论]
(3)同学们拟选用下列实验装置完成实验:
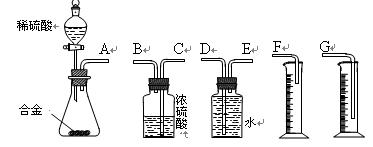
①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
 A.待实验装置冷却后再读数
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平,读取量筒中水的体积
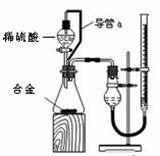
(4)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了下图所示的实验装置。
①装置中导管a的作用是 。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为____________mL。
28.(10分)① A、B、C、D四种物质均含有元素X,有的还可能含有元素Y或者Z。元
素Y、X、Z的原子序数依次递增,H2在X中燃烧产生苍白色火焰。
② X在A、B、C、D中的化合价分别为0、-1、+1、+5。
③ 室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④ 化合物D受热催化分解,可制得元素Y的单质。
请回答下列问题:
(1)写出元素X、Y、Z的元素符号:X: ,Y: ,Z 。
(2)写出③中反应的离子方程式 。
(3)写出④中反应的化学方程式 。
26.(6分)在反应K2Cr2O7 + 14 HCl = 2KCl + 2 CrCl3 + 3Cl2 ↑ + 7H2O 中,氧化剂是 反应中盐酸体现了 性和 性;转移电子数为 。此反应的离子方程式为 。
27(10分)已知有以下物质相互转化
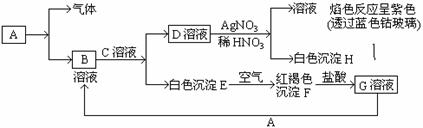
试回答:
(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出鉴别G溶液的阳离子的试剂是 ;向G溶液加入A的有关离子反应方程式 。
25.把a g 铝铁合金粉末溶于足量盐酸中,再加入过量氢氧化钠溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则此合金中铁的质量分数为
A.70% B.30%
C.52.4% D.22.2%
第II卷 非选择题
24.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2
向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中
A.有铜无铁 B.有铁无铜
C.铁、铜都有 D.铁、铜都无
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com