
题目列表(包括答案和解析)
2、下列属于微量元素的是( )
A.H B.F C.N D.O
1、 “绿色化学”要求从根本上减少乃至杜绝污染。下列对农作物收割后留下的秸杆的处理方法,不符合“绿色化学”的是 ( )
A.就地焚烧 B.发酵后作农家肥 C.加工成精饲料 D. 制造沼气
24.在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应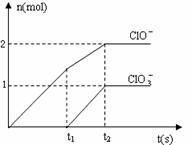 均为放热反应)。生成物中含有Cl-、C1O-、
均为放热反应)。生成物中含有Cl-、C1O-、
C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
(1)t2时,Ca(OH)2与Cl2发生反应的总化学方程式为:______________________ 。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后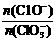 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若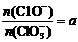 ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
23.已知硫铁矿的主要成分是FeS2(铁元素呈+2价,硫元素呈-1价)。以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
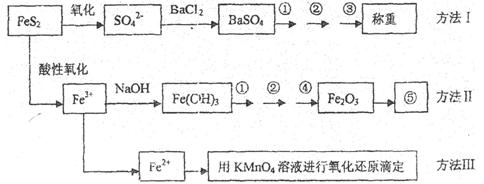
请同答下列问题:
(1)流程图中操作①、②、③分别指的是:①____________、②___________、③________。
操作④、⑤用到的主要仪器是:④_________、⑤__________(每空填1-2个仪器)。
(2)判断溶液中SO42-离子己沉淀完全的方法是______________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有
A、砝码生锈 B、定容时俯视
C、称量时物质和砝码位置反了(需要游码) D、容量瓶用待装液润
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______________________________________。
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是_________________________。
22.向盛有KI溶液的试管中加入少许 后滴加氯水,
后滴加氯水, 层变成紫色。如果继续向试管中滴加氯水,振荡,
层变成紫色。如果继续向试管中滴加氯水,振荡, 层会逐渐变浅,最后变成无色。
层会逐渐变浅,最后变成无色。
完成下列填空:
(1) 写出并配平 层由紫色变成无色的化学反应方程式,请在方框内填写物质,短线上填写系数。
层由紫色变成无色的化学反应方程式,请在方框内填写物质,短线上填写系数。
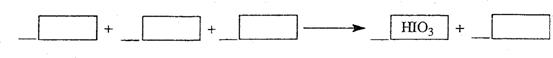
(2)整个过程中的具有还原性的物质有___ 。
(3)把KI换成KBr,则 层变为__色:继续滴加氯水,
层变为__色:继续滴加氯水, 层的颜色没有变化。
层的颜色没有变化。 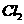 、
、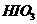 、
、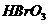 氧化性由强到弱的顺序是______。
氧化性由强到弱的顺序是______。
(4)加碘盐中含碘量为20mg-50mg/kg。制取加碘盐(含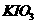 的食盐)1000kg,若用KI与
的食盐)1000kg,若用KI与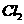 反应制
反应制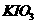 ,至少需要消耗
,至少需要消耗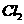 ________L(标准状况,保留2位小数)。
________L(标准状况,保留2位小数)。
21.已知X、Y、Z三元素的质子数都小于18且依次增大,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y形成的单质是空气的主要成分,则
(1)写出元素符号:X是 、Y是 、Z是
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的离子
有 (写出离子符号,只要写出2种)
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式是
20.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+ 、Cl-、Mg2+、Ba2+、CO32 -、SO42 -,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
A.K+可能存在 B.100 mL溶液中含0.01 mol CO32 -
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
19.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+ → Fe2+ MnO4- → Mn2+ Cl2 → Cl- HNO2 → NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.Fe3+ B.MnO4- C.Cl2 D.HNO2
18. 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,则下列关系中不正确的是
A.ρ = (17V + 22400) / (22.4 + 22.4V) B.ω = 17c / (1000ρ)
C.ω = 17V / (17V + 22400) D.c = 1000Vρ / (17V + 22400)
17. 金属钾的冶炼可采用如下两种方法,方法一:K2CO3 + 2C 2K↑+ 3CO↑,
2K↑+ 3CO↑,
方法二:2KF + CaC2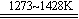 CaF2 + 2K↑+ 2C。下列有关说法合理的是
CaF2 + 2K↑+ 2C。下列有关说法合理的是
A.方法一中碳元素只被氧 B.方法二CaC2中碳的化合价为+1
C.方法二中氧化剂和还原剂的物质的量之比为2∶1
D.两种方法中,当生成相同物质的量的K时,转移的电子数相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com