
题目列表(包括答案和解析)
6、在元素周期表的金属元素和非金属元素交界处,最容易找到的材料是( )。
A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料
C.制农药的材料 D.制半导体的材料
5、下列化合物电子式书写正确的是( )。
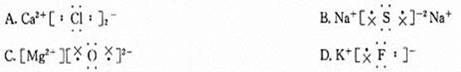
4、下列说法中正确的是( ) 。
A.含有离子键的化合物必是离子化合物
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键
D.离子化合物中不可能含有共价键
3、在下列元素中,最高正化合价数值最大的是( ) 。
A.Na B.P C.Cl D.Ar
2、关于碱金属元素的下列叙述中,错误的是( )。
A.碱金属元素原子最外层都只有1个电子
B.依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
C.随核电荷数递增,氢氧化物碱性增强
D.随电子层数增加,原子半径增大,金属还原性增强
1、对发现元素周期律贡献最大的化学家是( )。
A.牛顿 B.道尔顿 C.阿佛加德罗 D.门捷列夫
30.(7分)将 铜和氧化铜的混合物5.8 g加入到过量稀硝酸中,完全反应后产生的气体在标准状况下体积为1.12 L。试计算:
(1)原混合物中CuO的质量分数。w_w w.k_s 5*
(2)若最初加入的过量稀硝酸浓度为3 mol/L、体积为100 mL,完全反应后溶液的体积仍为100 mL,则该溶液中NO-3 的物质的量浓度是多少?w_w w.k_s 5*
 绵阳市高中2012级第二学年末教学质量测试
绵阳市高中2012级第二学年末教学质量测试
29.(3分)某元素的一种同位素X,质量数为A,含N个中子,它与1H 原子组成HmX 分子。a g HmX中所含质子的物质的量是 mol。
28.(3分)有A、B、C、D四种晶体,它们分别是NaNO3、Na2SO3、Na2SO4、(NH4)2SO4中的一种。用4种物质做实验,记录如下:

 w_w w. k#s5_
w_w w. k#s5_
①A与NaOH溶液反应,能产生使湿润石蕊试纸变蓝的气体;②在编号为B、C、D的3支试管中依次放入B、C、D三种物质的溶液,分别滴加BaCl2溶液,B中无现象,其余两支试管中产生白色沉淀。在有沉淀的试管中加入盐酸,C试管中沉淀溶解。w_w w.k_s 5*
推断A、B、C各是什么物质:A 、B 、C 。
27.(9分)某化学兴趣小组用铜和浓硫酸制取SO2,并检验SO2的性质,实验装置如下图所示:w_w w.k_s 5*

已知,酸性KMnO4溶液具有强氧化性,许多气体能够使酸性KMnO4溶液褪色。
请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是 。
(2)装置B中的现象是 ,装置D中的现象是 。
(3)分析实验意图,装置C证明SO2具有 性,装置E能够起到的两个作用是 、 。
(4)实验过程中还观察到A试管内产生黑色沉淀,黑色沉淀是副反应产物,可能是CuO、CuS和Cu2S。已知CuS和Cu2S均不溶于盐酸、硫酸。如何用化学方法证明黑色沉淀中没有CuO ? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com