
题目列表(包括答案和解析)
5.分子的电子式书写不正确的是

 w_w w. k#s5_u.c o*
w_w w. k#s5_u.c o*
A.氢分子H∶H B.氯化氢分子 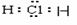
C.氮分子 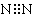 D.水分子 H
D.水分子 H 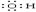
4.下列元素中,不属于主族元素的是 ( )
A.磷 B. 铁
C.钙 D.碘
3.原子半径由小到大,且最高正价依次降低的是 ( )
A. Al、Na、 Mg B. N、 O、 F
C. Ar 、Cl、 S D. Cl、P 、Si
1.元素周期表的发现与下列人物有关的是 ( )
A.拉瓦锡 B. 道尔顿
C. 汤姆逊 D.门捷列夫
2下列微粒的结构示意图中,表示阳离子的是 ( )

27.下图中A-G是化合物,A是一种正盐,H是一种无色气态单质,C在高温下是气体,而常温下是一种无色液体, E为含钠的化合物。它们之间有如下转化关系:
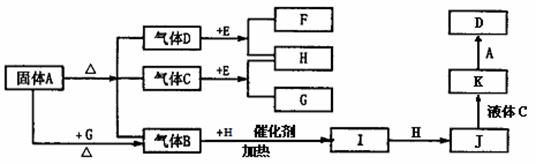 [
[

 w_w w. k#s5_
w_w w. k#s5_
(1)实验室检验A的阳离子的一种方法为
。
(2)K的浓溶液与碳单质反应的化学方程式
,B与H催化氧化的化学方程式 。上述转化中,属于氧化还原反应,且氧化剂和还原剂是同种物质的反应有 个。

 w_w w. k#s5_
w_w w. k#s5_
(3)K的稀溶液中通入SO2气体,发生的化学反应的离子方程式为
。
(4)H气体与H2S气体以4:5的体积比混合,电火花点燃后充分反应,发生反应的总的化学反应方程式为 。
(5)标准状况,将J与H按7:1的体积比充满烧瓶,将其倒置于盛有足量水的水槽中(假设进入烧瓶中的液体不扩散),实验结束后,烧瓶中溶液的物质的量浓度是 mol/L(计算结果保留3位小数)。
成都七中2009-2010学年度下期
26.根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),同时生成有一种对环境无害的气体,由此计算Ar(Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
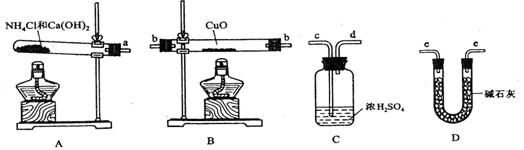
请回答下列问题:

 w_w w. k#s5_
w_w w. k#s5_
(1)检验装置A的气密性的方法是
。
(2)装置A中发生反应的化学方程式为 ,氨气还原炽热氧化铜的化学方程式为 。
(3)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→ 。
(4)在本实验中,若测得m(CuO)=ag,m(H2O)=bg,则Ar(Cu)= 。
(5)在本实验中,使测定结果Ar(Cu)偏大的是_______________(填序号)。
①CuO未完全起反应 ②CuO不干燥 ③CuO中混有不反应的杂质
④碱石灰不干燥 ⑤NH4C1与Ca(OH)2混合物不干燥
(6)在本实验中,还可通过测定______________和_____________,或_______________和_______________达到实验目的。
25.现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E是同族元素,且D最外层电子数是次外层电子数的3倍。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。请回答下列问题(填空时用化学符号作答):
(1)BC-的电子式为 ;元素F在周期表中的位置为 。
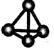 (2)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示。根据以上信息和数据,下列说法正确的是 。
(2)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示。根据以上信息和数据,下列说法正确的是 。
A.C4属于一种新型的化合物 B.C4与C2互为同素异形体
C.C4稳定性比P4(白磷)差 D.C4与C2互为同位素

 w_w w. k#s5_
w_w w. k#s5_
(3)A与C两种元素可形成多种化合物分子,其中CA3分子的分子的空间构型为
,键角 ;C2A4分子的结构式为 。
(4)为了除去化合物A2ED4稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为 。
(5)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是
A.E2F2的结构式为:F-E-E-F B.E2F2在一定条件下,有氧化性或还原性
C.E2F2中的两各E原子的化合价分别为0价和+2价

 w_w w. k#s5_
w_w w. k#s5_
D.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O=EO2↑+ 3E↓+4HF
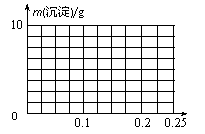
(6)B与D可形成两种常见化合物,其中一种化合物BD2是 分子(填“极性”或“非极性”)。在1000 mL 0.1 mol/L的 Ca(OH)2物质的水溶液中逐渐通入BD2并充分搅拌,溶液中析出沉淀的质量发生变化,在右图中画出沉淀质量随通入BD2的物质的量的变化曲线。
24.长期存放的亚硫酸钠可能会被氧化,某化学课外活动小组现通过实验来确定某无水亚硫酸钠变质,并测定亚硫酸钠的纯度。

 w_w w. k#s5_
w_w w. k#s5_
Ⅰ.有三位学生各取少量样品设计了下述三个实验方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证试液中有SO42-离子。你认为合理的方案有 。
方案甲:试液 白色沉淀
白色沉淀 白色沉淀。
白色沉淀。
方案乙:试液 有无色气体生成
有无色气体生成 白色沉淀。
白色沉淀。
方案丙:试液 无色溶液
无色溶液 白色沉淀。
白色沉淀。
Ⅱ.同学丁取35g该样品,加入800mL某浓度的盐酸,加热使生成的气体全部逸出,所得气体用氨水吸收,溶液增重16g。然后向原溶液中逐滴加入0.5mol/L的Ba(OH)2溶液500mL。有沉淀生成,此时溶液呈中性。
(1)用氨水吸收气体发生反应的可能的离子方程式
。
(2)样品中Na2SO3的纯度是 ,盐酸的物质的量浓度________________。
23.向盛有KI溶液的试管中滴加氯水后再加入少许CCl4,充分振荡后CCl4层呈紫色。如果继续向试管中滴加氯水,充分振荡,CCl4层又会逐渐变浅,最后变成无色。根据以上信息完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式,并用双线桥法标出电子转移的方向和数目:

 w_w w. k#s5_
w_w w. k#s5_
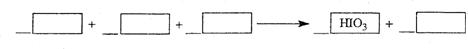
(2)实验中的有机溶剂CCl4还可以用 代替。
A.苯 B.煤油 C.酒精 D.醋酸
(3)若把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20mg-50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,计算结果保留1位小数)。
22.aL bmol/L的适量浓HNO3溶液中投入mg铜片,加热Cu片完全反应后,放出标准状况下的气体cL(不考虑NO2转化为N2O4),并测得反应后的溶液中C(H+)=dmol/L(设溶液体积不变)。下列说法正确的是

 w_w w. k#s5_
w_w w. k#s5_
A.c/22.4=ab-ad-m/32 B.m/64=ab-c/22.4
C.ab=ad+c/22.4 D.m/32=c/22.4
第Ⅱ卷 非选择题(共56分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com