
题目列表(包括答案和解析)
21 。
22 (1) (2) (3) (4) (5) .
23  (1)
(1)
(2) ①
②正极反应
负极 反应
③
(3)
27.(1)(4分)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g。请完成以下实验设计表,并完成实验目的一栏中的填空:
|
实验 编号 |
T/Km] |
大理石 规格 |
HNO3浓度 /(mol/L) |
实 验 目 的 |
|
① |
298 |
粗颗粒 |
2.00 |
(I)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究________________对该反应速率的影响; (Ⅲ)实验①和④探究________________对该反应速率的影响。 |
|
②[ |
298 |
粗颗粒 |
1.00 |
|
|
③ |
298 |
细颗粒 |
2.00 |
|
|
④ |
308K |
粗颗粒 |
2.00 |
(2)(4分)将11.2L(标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了8.4g,求原气体混合物中乙烯与乙烷的物质的量之比和质量比。
 2009-2010学年高一第二学期期末考试
2009-2010学年高一第二学期期末考试
化学试题
(1)
26、(6分)某温度时,在2L密闭容器中,X、Y、Z 三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式: ;
(2)反应开始至2min末,X的反应速率
为 (mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是 。
25、(10分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式: 。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
|
形成的化合物 |
甲 |
乙 |
丙 |
丁 |
戊 |
|
化合物中各元素的原子个数比 |
A:C=1:1 |
B:A=1:3 |
D:C=1:1 |
E:F=1:3 |
A:F=1:1 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置 。
② E元素的原子结构示意图为 ,乙的电子式为 ,丙的电子式为 ,B的最高价氧化物的水化物的化学式为 。
③向甲的水溶液中加入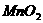 ,反应的化学方程式为
。
,反应的化学方程式为
。
24、(4分)已知某烃A含碳元素的质量分数为85.7%,可作果实催熟剂。
则由A制取高分子化合物的化学方程式为 。
A和水在一定条件下反应生成B。B为生活中常见的有机物,B可与另一种生活中常见有机物在一定条件下反应生成有香味的物质C,写出生成C的化学方程式 。
23、( 12分)从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表 示了三种金属被人类开发利用的大致年限。

(1)上述图中的三种常用金属的开发利用之所以有先后,主要取决于
(填选项序号)
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性大小
(2)早在西汉成书的《淮南万毕术》里,就有"曾青得铁则化为铜"的记载。曾青又有空青、 白青、石胆、胆矶等名称其实都是天然的硫酸铜。
①写出"曾青得铁则化为铜"的离子方程式 。
②若根据上述反应设计成原电池,请在方框中画出原电池的
 装置图,标出正、负极和电解质溶液,并写出电极反应式。
装置图,标出正、负极和电解质溶液,并写出电极反应式。
正极反应
负极反应
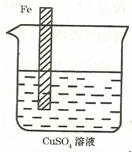
③设计一个实验方案,使如图装置中的铁棒上析出铜,而
铁的质量不变。(可用文字叙述也可用图示意)。
(3)铁路工人常用铝热反应来焊接钢轨,写出有关的化学方程式 。
教材中引发铝热反应的试剂是 。
22.(5分)下列各组物质:
① O2和O3 ; ② 1H、2H、3H; ③ CH4和C10H22; ④乙烷和(CH3)2CHCH2CH3;
⑤
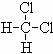 和
和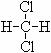 ;⑥
;⑥ 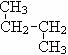 和
和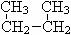
⑦
CH3 (CH2) 3 CH3和
(1)互为同位素的是 ;(2)互为同素异形体的是 ;(3)互为同系物的是 ;(4)互为同分异构体的是 ;(5)属于同一物质的是 。
21. (5分)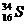 微粒中的质子数是
,中子数是
,核外电子数是 。它与
微粒中的质子数是
,中子数是
,核外电子数是 。它与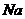 形成的化合物的电子式
,此化合物类型
(填“离子化合物”或“共价化合物”)。
形成的化合物的电子式
,此化合物类型
(填“离子化合物”或“共价化合物”)。
20、一定温度下,可逆反应2NO2  2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;④混合气体的颜色不再改变的状态;⑤密闭容器中压强不再改变的状态;⑥混合气体的平均相对分子质量不再改变的状态。 ( )
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是:①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态;④混合气体的颜色不再改变的状态;⑤密闭容器中压强不再改变的状态;⑥混合气体的平均相对分子质量不再改变的状态。 ( )
A.①④⑤⑥ B.②③⑤⑥ C.①③④⑥ D.全部
第Ⅱ卷(非选择题)
19、已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的能量,Y的能量一定低于N的能量
B.X和Y的总能量一定低于M和N的总能量
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.因为该反应为吸热反应,故反应一定要加热才能进行
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com