
题目列表(包括答案和解析)
7.X元素原子的最外层电子数是Y元素原子最外层电子数的3.5倍,则它们形成的化合物的化学式为( )
A. X2Y7 B.Y2X7 C.Y2X D、YX2
6.某元素的气态氢化物为HnR,,其最高价氧化物对应的水化物分子中有m个氧原子,则其最高价氧化物对应的水化物的化学式为( )
A.H2m-8+nROm B. H2n-8+mROm C.H2ROm D. H2mROm
5.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
A.X的原子序数比Y的小 B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大 D. X元素的最高正价比Y的大
4.核电荷数位1~18的元素中,下列叙述正确的是( )

 w_w w. k#s5_
w_w w. k#s5_
A.最外层只有一个电子的元素一定是金属元素
B.最外层只有两个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是金属元素
D.两种粒子,若核外电子排布完全相同,则其化学性质一定相同
3.下列说法正确的是( )
A.某微粒核外电子排布为2、8、8结构,则该微粒一定为氩原子
B.最外层达稳定结构的微粒只能是稀有气体的原子
C. F- Na+ Mg2+ Al3+与Ne原子具有相同电子层结构的离子
D.NH4+和H3O+具有相同的质子数和不同的电子数
2.关于 1940 K的叙述,不正确的是( )
A、原子核内有21个中子 B、中子数为19
C、质量数为40 D、核外电子数为19
1. 下列四组物质中,两种分子具有不同核外电子数的是( )
A、H2O2和CH3OH B、HNO2和HClO
C、H2O和CH4 D、H2S和F2
22.(11分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,A对氢气的相对密度为14;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
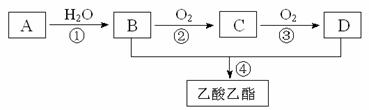
回答下列问题:
(1)A的相对分子质量为: ;结构简式为: 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型:
① ,④ 。
(4)写出下列反应的化学方程式:
① ;
④ 。
21.(7分)下表为元素周期表的一部分,请回答有关问题:
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
2 |
|
|
|
|
① |
|
② |
|
3 |
③ |
④ |
⑤ |
⑥ |
|
⑦ |
⑧ |
(1)④和⑦的元素符号是 和 ;
(2)表中8种元素中,金属性最强的元素的元素符号是 ,非金属性最强的元素的元素符号是 。
(3)表中能形成两性氢氧化物的元素名称是 ,写出该元素的氢氧化物与③的最高价氧化物对应水化物反应的离子反应方程式: 。
20.(11分).实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手实践,有关实验步骤和现象记录如下:
(注意:表中的“实验步骤”与“实验现象”前后不一定是对应关系)
|
实验步骤 |
实验现象 |
|
① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
|
②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 |
B.有气体产生,溶液变成浅红色 |
|
③将镁条投入稀盐酸中 |
C.剧烈反应,迅速产生大量无色气体 |
|
④将铝条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
|
⑤向A1Cl3溶液中滴加NaOH溶液至过量 |
E.生成白色胶状沉淀,继而沉淀消失 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠、镁条、铝条、稀盐酸、AlC13溶液、NaOH溶液、酚酞溶液等。
实验所用到的玻璃仪器:① 、② 、③ 以及胶头滴管、玻璃片等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和②的化学方程式)
|
实验内容 |
① |
② |
③ |
④ |
⑤ |
|
实验现象(填A-F) |
|
|
C |
D |
|
②的化学方程式 。
(4)此实验的结论:钠、镁、铝的金属性强弱 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com