
题目列表(包括答案和解析)
1.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施中,不利于“蓝天工程”建设的是: ( )
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的使用量
(1)NaOH溶液的物质的量浓度是多少?
(2)若取51.6g固体混合物与140mLNaOH溶液混合,会产生多少体积的气体(标况)?
(3)若固体仍取51.6g,而NaOH溶液取180mL时,又会产生多少体积的气体(标况)?
26、(11 分) I .如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
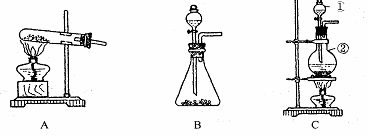
(1) 选用A装置可制取的气体有 ,选用B装置可制取的气有 ,
通常选用C装置制取的气体有 。
(2) 写出利用上述有关药品制取氨气的化学方程式: 。
若要制得干燥的氨气,可选用下列干燥剂中的 (填序号)
a. 生石灰 b. 浓硫酸 C. 五氧化二磷 d. .碱石灰
II. (3) 实验室制取的一氧化氮气体利用右图装置选用必要试剂如何进行收集?
。
III.(4) 现安装一套实验室利用液一液反应制备气体的装置。有人设计了五步操作,请你安排出正确而简捷的程序,将序号填入括号内。
( )将蒸馏烧瓶固定在铁架台上。
( )把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定铁圈,放好石棉网。
( )用漏斗向蒸馏烧瓶中加入一种液体反应物,再向分液漏斗中加入另一种液体反应物,并将导气管放入气体收集器中。
( )检查装置的气密性(利用对固定装置进行微热的方法来检查气密性,假定瓶口漏气而需要更换橡皮塞)。
( )在蒸馏烧瓶上装好分液漏斗,连接好导气管。
25. (8分) 已知A为一种白色易溶于水的正盐晶体,B是一种有重要用途的气体,C、G都为氧化物,E是一种能使品红溶液褪色的气体,H为红色金属单质,I为空气中含量最多的单质。它们之间的转化关系如下图所示:
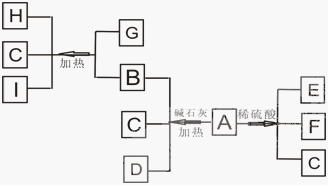
⑴ A的化学式(分子式)为 ,I的电子式为 。
⑵ B物质有一些特殊的性质,由于易 ,所以常用作致冷剂;当人的眼睛不慎接触过多的B气体时,要 。
⑶ G和B生成H、C、I的化学方程式是 。
⑷ A与稀硫酸反应的离子方程式是 。
24.(16分)现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。
已知:①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸。
③C的氢化物分子G是具有10电子微粒,且以发生下列转化


G P Q M+P
④E和D是同一主族的元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
请回答下列问题:
(1)B元素的名称是 ;
(2)E元素的原子结构示意图是 。
(3)请将A、C的元素符号填在如图所示部分元素周期表的适当位置上。
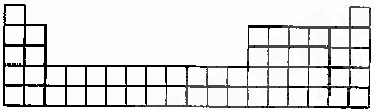
(4)G的电子式为 ,属于 分子(填“极性”或“非极性”),用离子方程式表示G使红色石蕊试液变蓝的因: 。
化合物X所含化学键类型有 。
(5)A的氧化物与NaOH溶液反应的离子方程式: 。
T与F单质的水溶液反应的离子方程式为 ;
G的水溶液与足量的T反应的化学方程式为 ;
23、(4分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质/元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃ ) |
– 218.4 |
113 |
|
452 |
|
单质沸点(℃ ) |
– 183 |
444.6 |
685 |
1390 |
|
主要化合价 |
– 2 |
– 2、+ 4、+ 6 |
– 2、+ 4、+ 6 |
|
|
原子半径 |
→ 逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据上表回答下列问题:
(1) 硒的熔点范围可能是______________________;
(2) 碲的化合价可能有_________________;
(3) 硫、硒、碲的氢化物的稳定性由强至弱的顺序是_________________________(填化学式)。
(4) 氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质。
(1)除铁粉中少量的氧化铝______ __;
(2)出去碳酸氢钾溶液中少量的碳酸钾_____________;
(3)除去二氧化硅中少量的氧化钙 ;
(4)除去氯气中少量的氯化氢气体 。
22、(6分)中国目前所藏最早的玻璃制品是战国时代的遗物。玻璃与人们的生产生活密切联系。
(1)一般住宅的窗玻璃是普通玻璃,工业上将纯碱(Na2CO3)、石灰石(CaCO3)和石英(SiO2)粉碎后放入玻璃窑中在高温下反应生成玻璃。普通玻璃的主要成分为 。
(2)在玻璃中加入某些金属氧化物,可以制成彩色玻璃。如加入Co2O3的玻璃呈蓝色。日常生活中见到的普通玻璃一般呈淡绿色,其原因是原料中混有 _ _____的缘故。
(3)某玻璃中含Na2O、CaO、SiO2的质量之比为31︰28︰180,此玻璃的组成为 (填选项)。
A.Na2O·CaO·6H2SiO3 B.Na2O·CaO·6SiO2
C.2Na2O·2CaO·9SiO2 D.6Na2O·6CaO·SiO2
18、在一定体积的的18mol·L-1的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9mol,则浓硫酸的实际体积为
A.等于50 mL B.大于50 mL
C.等于100 mL D.大于100 mL19、臭氧(O3)能使湿润的淀粉碘化钾试纸变蓝,化学反应式为:2KI+O3+H2O=2KOH+I2+O2, 根据上述反应,下列叙述中正确的是
A、O3的氧化能力大于O2 B、反应中氧化产物O2与还原产物I2的物质的量之比为1:1 C、1molO3在反应中得到6mole- D、该反应中的还原产物是KOH20、将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是
A. Na2SiO3 B. Na2CO3、Na2SiO3
C. Na2CO3、SiO2 D. SiO2w
米易中学高2012级2010年6月月考化学试卷
第II卷(非选择题,共60分)
17、实验室保存下列试剂的方法有错误的是
A、硅酸钠溶液保存在有橡胶塞的试剂瓶中
B、氢氟酸保存在磨口玻璃试剂瓶中
C、固体烧碱放在广口塑料试剂瓶中
D、浓溴水存放在磨口玻璃试剂瓶中
16、在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
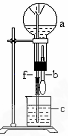
|
|
a(干燥气体) |
b(液体) |
|
(A). |
NO2 |
水 |
|
(B). |
CO2 |
NaHCO3溶液 |
|
(C). |
Cl2 |
饱和NaCl溶液 |
|
(D). |
NH3 |
1 mol·L-1盐酸 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com