
题目列表(包括答案和解析)
4.下列表示化学用语或模型正确的是
A.8个中子的碳原子的核素符号:12C B.H2O的电子式:
C.Cl-离子的结构示意图: D.CH4分子的填充(或比例)模型:
D.CH4分子的填充(或比例)模型:
3.下列离子在溶液中能大量共存的是 ( )
A.Ba2+、SO42- 、K+、 OH- B. Na+、H+、NO3-、SO42-
C.Al3+、HCO3- 、K+、 OH- D.Fe2+、NH4+、NO3-、H+
2.下列核素中,中子数和质子数相等的是 ( )
①18O;②12C;③26Mg;④40K;⑤32S
A.①② B.②⑤ C.只有④ D.③④
1.2010年上海世博会的主题是“城市,让生活更美好”。下列叙述中与该主题不相符的是( )
A.世博会期间,某些馆的外壳使用非晶硅薄膜,以充分利用太阳能
B.世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染
C.世博会一些场馆使用的钢筋混凝土属于有机高分子化合物
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体
21.(11分) 现有下列短周期元素性质的相关数据:
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
原子半径(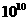 m) m) |
1.30 |
0.82 |
0.99 |
1.11 |
0.90 |
1.18 |
|
最高或最低化合价 |
+2 |
+3 |
+7 |
+4 |
+2 |
+3 |
|
|
|
-1 |
-4 |
|
|
请回答下列问题:
(1) ②和③形成的化合物类型为 (填“离子”或“共价”)化合物;
(2) 元素①的金属性比元素⑥要 (填“强”或“弱”),试从原子结构方面解释其原因: ;
(3) 在自然界中,元素④的存在形态为 ;
(4) ⑥的单质与氧化铁高温下反应的化学方程式是 ,工业冶炼⑥
的单质的化学方程式是 ;
(5) 实验室现有元素①的单质和某未知金属单质M,请简要写出比较两者金属性强弱的一种
实验方案
。
20.(10分) 某课外实验小组利用稀硫酸与金属铁反应探究影响化学反应速率的因素,得到
如下实验数据:
|
实验 序号 |
铁的 质量/g |
铁的 形态 |
 /mol· 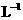 |
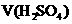 /mL |
溶液温度/℃ |
金属消失 的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
铁片 |
0.7 |
50 |
20 |
36 |
250 |
|
2 |
0.10 |
铁片 |
0.8 |
50 |
20 |
35 |
200 |
|
3 |
0.10 |
铁粉 |
0.8 |
50 |
20 |
36 |
25 |
|
4 |
0.10 |
铁片 |
1.0 |
50 |
20 |
35 |
125 |
|
5 |
0.10 |
铁片 |
1.0 |
50 |
35 |
50 |
20 |
分析上述数据,回答下列问题;
(1) 实验2和3表明, 对反应速率有影响,影响规律是
;
(2) 仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号):
(3) 本实验中影响反应速率的其他因素还有 ,能体现该影响因素的实验序号
是 ;
(4) 在实验4中滴入几滴硫酸铜溶液,金属消失的时间小于125s。原因是
;
(5) 实验中的所有反应,反应前后溶液的温度变化值 (约15℃) 相近,试从反应过程能量的
变化角度推测其原因
。
19.(10分) 如果在试管甲中先加入4,6g乙醇,并在摇动下缓缓加入2mL浓硫酸,充分
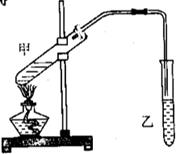 摇匀,冷却后再加入3g无水乙酸,用玻璃棒充分搅拌后
摇匀,冷却后再加入3g无水乙酸,用玻璃棒充分搅拌后
试管固定在铁架台上:在试管乙中加入5mL饱和碳酸钠
溶液,按右图连接装置,用酒精灯对试管甲加热,当观
察到试管乙中有明显现象时停止加热。试回答:
(1) 试管乙中观察到的现象是 ;
加入浓硫酸的目的是 。
(2) 写出试管甲中进行反应的化学方程式 (有机物写结构简
式);
。
 (3) 装置中伸向乙试管的导管没有插到饱和
(3) 装置中伸向乙试管的导管没有插到饱和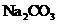 溶液的液面
溶液的液面
以下,是有一定的理由的,但这样做会使较多的产物挥发到
空气中,现有人对此作出如下改进 (见右下图),该装置中球
形管的作用是 (两点)
(4) 如果该反应的实际产率是理论产率的67%,则可得到乙酸乙酯
的质量是 。
18.(7分)“温室效应”是全球关注的环境问题之一。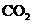 是目前大气中含量最高的一种温室气体。因此,控制和治理
是目前大气中含量最高的一种温室气体。因此,控制和治理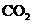 是解决温室效应的有效途径。
是解决温室效应的有效途径。
(1) 下列措施中,不利于降低大气中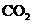 浓度的有 (填字母)。
浓度的有 (填字母)。
a.减少化石燃料的使用 b.植物造林,增大植被面积
c.用家用小汽车代替公交车 d.利用太阳能、风能、潮汐能
e.采用节能技术,尽可能地降低含碳麟料的用量
(2) 将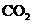 转化为有机物可有效实现碳循环。
转化为有机物可有效实现碳循环。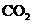 转化成有机物的例子很多,如:
转化成有机物的例子很多,如:
a.
b.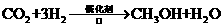
c.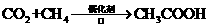
d.
以上反应中,最节能的是 ,原子利用率最高的是 。(填字母)
(3) 该题“第(2)问”中的一种有机物能与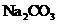 溶液反应放出
溶液反应放出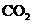 该有机物所含的官能
该有机物所含的官能
团是 (写名称)。 “第(2)问”d反应的生成物在催化剂条件下可以生成
一种常见液体燃料,写出该反应的化学方程式
。(4) 为了控制温室效应,各国科学家提出了不少方法和设想。有人根据液态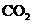 密度大于
密度大于
海水密度的事实,设想将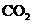 液化后。送入深海海底,以减少大气中
液化后。送入深海海底,以减少大气中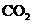 的浓度。为
的浓度。为
使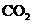 液化,可采取的措施是 (填字母)。
液化,可采取的措施是 (填字母)。
a.减压,升温 b.增压、升温 c.减压、降温 d.增压、降温
16.化学中存在一些守恒或平衡原理,下列叙述正确的是
A.根据质量
(原子) 守恒定律.某物质完全燃烧的产物是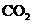 和
和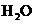 ,则该物质一
,则该物质一
定是烃
B.根据能量守恒定律,所有化学反应的反应物的总能量一定等于生成物的总能量
C.根据电子守恒定律,原电池中负极反应失电子数一定等于正极反应得电子数
D.根据化学平衡原理,可逆反应的正反应速率在任何时刻一定等于逆反应速率
第II卷 (非选择题,共52分)
基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1) L的元素符号为 ;M在元素周期表中的位置为 ;五种元素的原子半
径从大到小的顺序是 (用元素符号表示)。
(2) Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为 ,B
的结构式为 。
(3) 硒 (se) 是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se
的原子序数为 ,其最高价氧化物对应的水化物化学式为 。该族2-5
周期元素单质分别与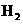 反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化
反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化
氢反应热的是 (填字母代号)。
a.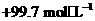 b.
b.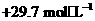
c.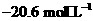 d.
d.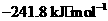
(4) 用M单质和石墨作电极,NaOH溶液作电解质溶液形成原电池,生成易溶物R。写出阳
极生成R的电极反应式: 。
15.以下叙述中,错误的是
A.钠单质与氯气反应后,体系的能量降低,稳定性增强
B.需要加热才能发生的反应一定是吸热反应
C.反应物的总能量高于生成物的总能量时,则反应释放能量
D.化学反应的实质是旧化学键断裂和新化学键形成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com