
题目列表(包括答案和解析)
10.解析:(1)混合气体进入反应管中,混合气体中的S02被I2吸收,剩余的气体为N2和02。量气管内增加水的体积即为N2和02的总体积。
(2)当反应管内蓝色消去,说明I2与SO2恰好反应,若继续通入气体,则未反应的SO2也会排入量气管中,使N2、02的体积增大,测得S02的含量降低。
(3)反应管中I2与淀粉的作用是吸收SO2,且恰好完全反应时溶液由蓝色变无色来指示反应的终点。其他一些能氧化SO2,且溶液有颜色变化的物质可代替I2和淀粉,如酸性KMn04溶液或溴水。
(4)因SO2+I2+2H2O==H2S04+2HI n(SO2)=n(I2)=V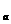 ×10
×10 L×cmol·L
L×cmol·L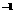 =
V
=
V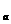 c
c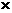 l0
l0 mol V(SO2)= V
mol V(SO2)= V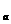 c
c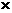 l0
l0 mol×22400mL/mol=22.4cV
mol×22400mL/mol=22.4cV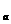 mL
mL
即S02的体积分数为: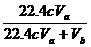 ×100%
×100%
(5)由所给装置可知,反应管起密封容器的作用,因此,可用试管或广口瓶代替,而量取气体还可用测量气体所排出液体的体积确定,可用广口瓶、双孔塞、量筒代替量气管。其装置可以为:b、c、e、g或b、e、g或c、e、g。
答案:(1)N2、02 (2)偏低 (3)酸性高锰酸钾溶液或溴水
(4)V(S02)%=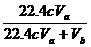 ×100%
×100%
2
(5)b、c、e、g或b、e、g或c、e、g
9.(1)蒸馏原理,即利用加热海水时,盐不挥发而留在残余物中,水蒸气经冷凝而得淡水 (2)HR ROH
(3)若在A中装ROH,则海水先通过ROH,溶液中就会有较多的OH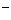 与海水中的M
与海水中的M 生成M(OH)n沉淀,造成堵塞现象,而在A中装HR,在B中装ROH,海水通过A中生成的H
生成M(OH)n沉淀,造成堵塞现象,而在A中装HR,在B中装ROH,海水通过A中生成的H 与B中生成的OH
与B中生成的OH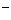 中和,生成水而呈中性
中和,生成水而呈中性
8.C。据元素守恒原理可得以下关系式:
CO - C02 - CaCO3
1mol lmol 100g
O.04mol 0.04mol 4 g
此时,气体增加的质量为O.04mol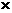 16 g·mol
16 g·mol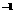 ==O.64 g(即0.04mol氧原子的质量,也就是氧化物中氧元素的质量),据质量守恒原理知,固体质量必定减少0.64 g,那么剩余固体的质量(即
==O.64 g(即0.04mol氧原子的质量,也就是氧化物中氧元素的质量),据质量守恒原理知,固体质量必定减少0.64 g,那么剩余固体的质量(即
1
铁粉的质量)为2.88 g-O.64 g=2.24 g,也就是说,原氧化物中含铁元素的物质的量为2.24g/56 g·mol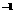 =O.04mol。因此,原氧化物中铁元素和氧元素的物质的量之比即Fe、0原子个数之比为0.04:0.04=1:1。
=O.04mol。因此,原氧化物中铁元素和氧元素的物质的量之比即Fe、0原子个数之比为0.04:0.04=1:1。
7.D。SO2和O2的反应是一个可逆反应,反应速率很慢,在空气中漂尘的催化作用下,大大加快了反应速率,使大部分S02转化为S03,进而与水反应生成硫酸而形成酸雨。
6.D。汽车在工作时发动机的活塞在气缸中运行一个循环时,要经过进气、压缩、点火燃烧和排气四个过程。在压缩和点火燃烧等过程中,由于产生高温高压,故空气中N2和02发生如下反应N2+02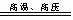 2NO,2NO+02==2N02,生成污染大气的N02。
2NO,2NO+02==2N02,生成污染大气的N02。
5.B。提纯光卤石得到MgCl2的步骤为:先将光卤石溶解于水,因为KCl、MgCl2均易溶于水,先后沉淀Mg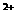 ;Mg(OH)2的溶解度比Ca(OH)2更小,故加入适量的Ca(OH)过滤后得Mg(OH)2,洗涤后溶于适量的盐酸发生反应:Mg(OH)2+2HCl==MgCl2+2H2O,蒸发溶液得MgCl2·6H20,由于加热MgCl2·6H2O的过程中,会有部分MgCl2又与H20反应生成Mg(OH)2。而MgCl2与H20的反应是一个可逆反应:MgCl2+2H20==Mg(OH)2+2HCl。根据平衡移动原理在HCl气氛中加热MgCl2·6H20,使MgCl2与H20的反应得到抑制,故能得到纯净的MgCl2
;Mg(OH)2的溶解度比Ca(OH)2更小,故加入适量的Ca(OH)过滤后得Mg(OH)2,洗涤后溶于适量的盐酸发生反应:Mg(OH)2+2HCl==MgCl2+2H2O,蒸发溶液得MgCl2·6H20,由于加热MgCl2·6H2O的过程中,会有部分MgCl2又与H20反应生成Mg(OH)2。而MgCl2与H20的反应是一个可逆反应:MgCl2+2H20==Mg(OH)2+2HCl。根据平衡移动原理在HCl气氛中加热MgCl2·6H20,使MgCl2与H20的反应得到抑制,故能得到纯净的MgCl2
4.C。煤的综合利用包括煤的干馏(焦化)、气化和液化。石油的综合利用包括分馏、裂化、重整等。煤变为煤饼,并未改变其成分及结构。
3. C。铝热反应是干态的置换反应,铝把比它活动性弱的金属从其氧化物中置换出来;铝热反应适用于冶炼高熔点金属,MgO与Al不反应。
2.B、C。煤的干馏过程中既有化学变化也有物理变化;煤的成分中既有有机物也有无机物;煤干馏所得的煤焦油是工业上获得芳香烃的重要来源。
1.D。煤的燃烧和鞭炮的燃放会产生有毒气体S02等;飞机、汽车尾气中含有CO、NO等有害气体;工业废气中含有更多的有毒、有害气体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com