
题目列表(包括答案和解析)
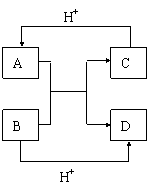
21.(9分)将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
|
金属 |
电子流动方向 |
电压/V |
|
Fe |
Fe → Cu |
+0.78 |
|
Zn |
Zn → Cu |
+1.10 |
|
A |
Cu → A |
-0.15 |
|
B |
B → Cu |
+0.3 |
根据实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越 。(填“大”、“小”)。
(2)Zn、A、B三种金属活动性由强到弱的顺序是 。
(3)Cu与A组成的原电池, 为负极,
此电极反应式为 。
(4)A、B形成合金,露置在潮湿空气中, 先被腐蚀。
(5)铝热反应中的铝热剂的成分是
 工业上常用的铝的冶炼的化学方程式为
。
工业上常用的铝的冶炼的化学方程式为
。
20.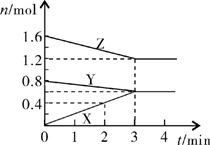 (6分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(6分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式:
;
(2)反应开始至2min末,X的反应速率为
;
(写出具体表达式)
(3)3min后图中曲线所表示的含义是 。
19.(7分)“阿波罗号飞船”所用的氢氧燃料电池的电极应为:负极:2H2+4OH--4e-=4H2O
则正极反应为 - 该电池工作时,通氢气的一极发生
- 反应 (填氧化、还原), 每转移4摩电子,电池内增加 摩水,负极附近溶液的PH值 ,(填升高、降低、不变),正极附近
[H+] (填升高、降低、不变)
18.把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:
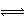 3A(g)+B(g) 2C(g)+xD(g);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是 ( )
3A(g)+B(g) 2C(g)+xD(g);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是 ( )
A.降低平衡体系的温度,逆反应速率变小,正反应速率增大,平衡正向移动
B.恒温下达到平衡的标志是C和D的生成速率相等
C.A的平均反应速率为0.15mol·(L·min)-1
D.B的转化率为25%
17.在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4(s) 时刻测得各物质
|
测定时刻/s |
t1 |
t2 |
t3 |
t4 |
|
c(A) /
(mol·L-1) |
6 |
3 |
2 |
2 |
|
c(B) /
(mol·L-1) |
5 |
3.5 |
3 |
3 |
|
c(C) /
(mol·L-1) |
1 |
2.5 |
3 |
3 |
的浓度如右表。据此下列结论正确的是 ( )
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:
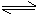 2A
+ B
C
2A
+ B
C
D.在t2~t3内A的平均反应速率为
[1/(t3-t2)]mol/(L·s)
16.一定温度下,向a L密闭容器中加入2mol NO2(g),发生如下反应:
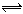 2NO2 2NO + O2 ,此反应达到平衡状态的标志是 ( )
2NO2 2NO + O2 ,此反应达到平衡状态的标志是 ( )
A.混合气体的密度不再变化
B.混合气体的颜色变浅
C.混合气体中NO2、NO、O2 的物质的量之比为2︰2︰1
D.单位时间内生成 2n mol NO同时生成2n mol NO2
15.下列说法正确的是 ( )
A.若氢气和氧气化合是放热反应,则水电解生成氢气和氧气是吸热反应
B.需要加热才能进行的反应是吸热反应
C.反应放出热量的多少与反应物的质量和状态无关
D.对放热反应A+B→C+D ,A、B的能量总和大于C、D的能量总和
14.已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A依次减小,B和E同主族.下列推断正确的是 ( )
A.A、B、E可能在同周期 B.C的最高价氧化物的水化物可能显碱性
C.D不可能在同一主族 D.C和D的单质可能化合形成离子化合物
13.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是 ( )
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
12.反应3A(g) + B(g) == 2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为:①vA==1mol/L·min ② vC==0.5 mol/L·min ③ vB==0.5 mol/L·min,三种情况下该反应速率大小的关系正确的是 ( )
A.③>①>② B.③>②>①
C.①>②>③ D.②>①>③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com