
题目列表(包括答案和解析)
27.(11分)设计燃料电池使汽油氧化直接产生电流,是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以辛烷(C8H18)为汽油的代表物,则这个电池放电时必发生反应的化学方程式
是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- =8CO2 + 9H2O +50e-,,正极的电极反应式为 ,固体电解质里O2-的移动方向是 。
(3)用此电池分别电解以下两种溶液,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了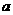 g M,则金属M的相对原子质量
g M,则金属M的相对原子质量
(用含“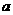 、x”的表达式表示)。
、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是 ;将电解后的溶液加水稀释至1L,此时溶液的c(H+)= 。
26. (10分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准硫酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入甲基橙作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗硫酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL蒸馏水,测得所耗硫酸为V2mL。
 试回答下列问题:
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(3)上述操作步骤中两处错误分别是 ,
(请指出具体错误)。由此造成的测定结果分别是 , (填偏高、偏低或无影响)。
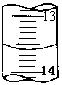
(4)某次滴定时的滴定管中的液面如图,则其读数为 mL。若记录读数时,起始时俯视,终点时仰视,则所测溶液浓度会 (填偏高、偏低或无影响)。
(5)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准硫酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.50 |
25.45 |
|
第二次 |
20.00 |
4.00 |
29.05 |
请计算待测烧碱溶液的浓度为 mol/L。
25.(7分)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
(1)体系中发生反应的化学方程式是________________________;
(2)该反应在0-3min时间内产物Z的平均反应速率:_____________;(保留小数点后三位)
(3)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
①_______________[
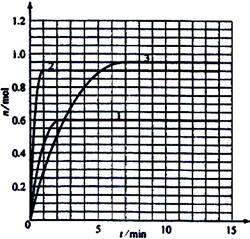 ②_______________
②_______________
③_______________
24.(3分)同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算。
已知:P4(s,白磷)+5O2(g)= P4O10(s) △H=-2983.2kJ·mol-1 ①
P(s,红磷)+O2(g)=P4O10(s) △H=-738.5kJ·mol-1 ②
(1)由热化学方程式来看,更稳定的磷的同素异形体是_____________________________。
(2)试写出白磷转化为红磷的热化学方程式___________________________________。
23.温度为a℃、压强为1.01×10Pa条件下,某密闭容器中,反应A(g)+B(g)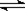 3C达到化学平衡,此时测得c(A)=0.022mol/L;保持温度不变,压缩容器使压强增大到2.02×106Pa,第二次达到平衡时测得c(A)=0.05mol/L;若保持温度不变,继续压缩容器使压强增大到4.04×107Pa,第三次达到平衡时测得c(A)=0.75mol/L。下列关于C物质状态的推测中正确的是 ( )
3C达到化学平衡,此时测得c(A)=0.022mol/L;保持温度不变,压缩容器使压强增大到2.02×106Pa,第二次达到平衡时测得c(A)=0.05mol/L;若保持温度不变,继续压缩容器使压强增大到4.04×107Pa,第三次达到平衡时测得c(A)=0.75mol/L。下列关于C物质状态的推测中正确的是 ( )
A.C为气态 B.第二次达到平衡时,C为气态
C.第三次达到平衡时,C为气态 D.C为非气态
22.在容积相同的甲、乙两个密闭容器中,均分别加入2molSO2和1mol O2,同时发生下列反应:2SO2(g)+O2(g)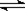 2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
A.反应过程中的某时刻,甲容器中的反应速率比乙中的大
B.达到平衡时,甲容器反应所需时间比乙容器少
C.乙容器中SO2的转化率大于25%
D.平衡时,乙容器中SO2、O2、SO3的浓度之比一定为2:1:2
21.下图 为直流电源,
为直流电源,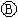 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现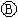 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点断路.下列叙述正确的是( )
后,使c、d两点断路.下列叙述正确的是( )
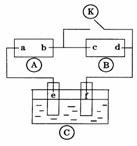 A.a为直流电源的负极
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
20.pH与体积均相同的氢氧化钠溶液和氨水,分别与同浓度、同体积的AlCl3溶液反应,生成沉淀的质量也相同,则可能是( )
A.AlCl3过量 B.AlCl3的量恰好与氢氧化钠完全反应
C.两种碱均过量 D.AlCl3的量恰好与氨水完全反应
19.下列各项中的两个量,其比例为2:1的是( )
A.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比
B.同温度下,0.2mol/LCH3COOH溶液与0.1mol/L CH3COOH溶液中的c(H+)之比
C.液面在“0”刻度,50mL酸式滴定管和25mL酸式滴定管内所盛溶液的体积
D.0.2mol/L的NaHSO3溶液中的阳离子与阴离子的浓度之比
18.将0.1mol·L-1CH3COOH溶液加水稀释或加入少量的CH3COONa晶体时都会引起
A.溶液的pH增加 B.溶液中的c(H+)增大
C.溶液的导电能力减弱 D.溶液中的c(OH-)减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com