
题目列表(包括答案和解析)
15. 往盛有纯Zn和稀H2SO4的容器中,滴入少量的CuSO4溶液,反应的速率会 加快 。
这是因为滴入CuSO4溶液后,Zn将Cu2+置换成Cu,Cu附在Zn的表面。此时Zn、Cu和稀H2SO4形成了无数个微小的 原电池 。(H+在Cu表面得电子比在Zn表面更易得到电子。因为Zn周围有Zn2+,H+受Zn2+的排斥。)从而使反应速率大大加快。
14. 下列说法正确的是( )
A.原电池是把电能转化为化学能的装置 B.原电池中电子流出的是正极发生氧化反应
C.原电池两极发生的均为氧化还原反应 D.形成原电池后,阳离子向正极移动
4、电解应用举例
①、电解熔融氯化钠
(1)电极反应: 阴极:2Na++2e- =2Na 阳极:2Cl--2e- = Cl2↑
(2)电解总的化学方程式 2NaCl(熔融) 2Na+
Cl2↑
2Na+
Cl2↑
②、电解熔融氯化镁
(1)电极反应: 阴极:Mg2++2e- = Mg 阳极:2Cl--2e- = Cl2↑
(2)电解总的化学方程式 MgCl2(熔融) Mg+
Cl2↑
Mg+
Cl2↑
③、电解熔融氧化铝
(1)电极反应: 阴极:4Al3++12e- =4Al 阳极:6O2-+12e- =3O2↑
(2)电解总的化学方程式 2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
[练习]
3、电极名称:阴极:与电源负极相连的电极称为阴极,发生还原反应。
阳极:与电源正极相连的电极称为阳极,发生氧化反应。
2、电解原理:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
1、电解池:将电能转化为化学能的装置叫电解池。
5、示例电池和电极反应:
①干电池
电极反应:负极(锌筒):Zn - 2e- = Zn2+;
正极(石墨):
总反应:
②.铅蓄电池
电极反应: 负极: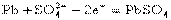
正极: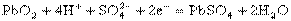
总反应:
③.燃料电池
电极反应: 负极:2H2 + 4OH- -2e- = 4H2O 正极:O2 + 2H2O + 2e- = 4OH-
电池的总反应为:2H2 + O2 = 2H2O
4、微粒移动方向:
电流由正到负。电子由负到正。 溶液中离子:阳向正阴向负。
3、电极反应和现象:
负极:一般为活泼金属,失电子,化合价升高,发生氧化反应。本身被溶解。
正极:一般为较不活泼金属(或非金属),本身不反应。溶液中的阳离子得电子,化合价降低,发生还原反应。电极上有单质生成(气体或金属)。
简略为:负氧正还 负溶正析
2、形成条件:1能发生氧化还原反应,2活性不同的两个电极,3闭合回路,4电解质溶液。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com