
题目列表(包括答案和解析)
19.(15分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、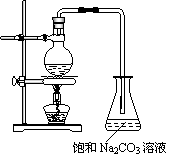 纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH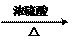 CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)若用右图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为:_____________________ _____、______________________________等。
(2)此反应以浓硫酸为催化剂,可能会造成____________、_________等问题。
(3)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
|
同一反应时间 |
同一反应温度 |
||||
|
反应温度/℃ |
转化率(%) |
选择性(%) |
反应时间/h |
转化率(%) |
选择性(%) |
|
40 |
77.8 |
100 |
2 |
80.2 |
100 |
|
60 |
92.3 |
100 |
3 |
87.8 |
100 |
|
80 |
92.6 |
100 |
4 |
92.3 |
100 |
|
120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
|
选择性100%表示反应生成的产物是乙酸乙酯和水 |
根据表中数据,下列__________(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
18.(19分)a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
4核 |
单核 |
5核 |
3核 |
|
带电荷数(单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a粒子的核外电子排布式
(2) b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 >
(用化学式表示)
(3) d溶于水的电离方程式
(4) g粒子所构成的化学键类型属
(5) c粒子是 ,f粒子是 (用化学式表示)
17.(9分)(1).2002年9月26日,中国北京曙光公司研制出了第-款具有我国完全自主知识产权的高性能CPU芯片--“龙芯”1号。
(a)“龙芯”(芯片)的主要化学成分是 ;
(b)在计算机长距离联网使用的传输很快的线路,其使用的材料叫 ,主要化学成分是 。
(c)如果(b)这种埋在地下的材料裸露在碱性土壤中,结果会断路,用离子方程式说明原因 。
16.(9分)在热的稀硫酸溶液中溶解了11.4gFeSO4。当加入50mL0.5mol/LKNO3溶液后,其中的Fe2+全部转化成了Fe3+,也反应完全,并有NxOy氮氧化物气体逸出。请推算出x= ,y= , 并配平该化学反应方程式(系数填在写下式方框内)
□FeSO4+□KNO3+□H2SO4→□K2SO4+□Fe2(SO4)3+□NxOy↑+□H2O
15.下列反应的离子方程式错误的是:
A. 碳酸钙溶于醋酸中:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
B. 饱和石灰水跟稀硝酸反应:OH- +H+=H2O
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=H2O+BaSO4↓
D. 碳酸氢钙溶液跟足量稀硝酸反应:HCO3-+H+=H2O+CO2↑
第II卷(80分)
14、下列物质之间的转化都能一步能实现的是
A.Cu→CuO→Cu(OH)2→CuSO4→CuCO3
B.Al→Al2O3→NaAlO2→Al(OH)3→Al2O3→Al
C.N2→NH3→NO→NO2→HNO3→NO2
D.S→SO3→H2SO4→SO2→Na2SO3→Na2SO4
13、X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
12、配制一定物质的量浓度的NaOH溶液时,造成所配制溶液浓度偏低的原因可能是
A.俯视溶液的凹液面正好跟刻度相平
B.在容量瓶中加水至刻度线与凹面相切
C.所用NaOH已变质和潮解
D.洗涤盛NaOH用的烧杯的冲洗液未倒入容量瓶中
11、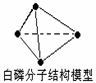 设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
A、常温常压下,3lg白磷(P4)分子中的共价键总数为1.5NA
B、标准状况下,22.4L CH3Cl和CCl4的混合物所含有分子数目为NA
C、2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
D、常温常压下,1mol碳烯(:CH2) 所含的电子数为6NA
10.已知下列元素的半径为:
|
原子 |
N |
S |
O |
Si |
半径r/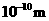 |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷原子的半径可能是( )
A.0.80×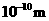 B.1.10×
B.1.10×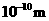
C.1.20×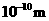 D.0.70×
D.0.70×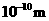
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com