
题目列表(包括答案和解析)
9.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx
与NaClO的物质的量之比为1:16,则x值是 A.2 B.3 C.4 D.5
8.将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液 中加入足量石灰水,得到A g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到B g沉淀,则下列说法正确的是
A.参加反应的CO2体积为0.224A L
B.用上述数据不能确定NaOH溶液的物质的量浓度
C.若A=B,则CO2与NaOH溶液反应的产物盐只有Na2CO3
D.B可能等于A、小于A或大于A
7.将2.4mol某金属投入1.8L 2mol/L的某酸溶液中,恰好完全反应,并产生7.2g氢气,则该金属和酸分别是
A.二价金属,二元酸 B.二价金属,三元酸 C.三价金属,二元酸 D.一价金属,一元酸
6.已知某溶液的:①体积;②密度;③溶质和溶剂的质量比;④溶质的摩尔质量,要根据溶质的溶解度计算其饱和溶液的物质的量浓度时,上述条件中必不可少的是
A.①②③④ B.①②③ C.②④ D.①④
5.设阿伏加德罗常数的符号为NA,标准状况下某种O2和N2的混合气体m克含有b个分子,
则n克该混合气体在相同状况下所占的体积(单位L)应是
A. 22.4nb/mNA B. 22.4mb/bNA C. 22.4nNA/mb D. nbNA/22.4m
4.某气体的摩尔质量为Mg·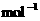 ,N表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则MX/VN表示的是
,N表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则MX/VN表示的是
A.以g为单位VL该气体的质量 B.以g为单位1L该气体的质量
C.1L该气体中所含的分子数 D.以L为单位1mol该气体的体积
2.根据阿伏加德罗定律,下列叙述中正确的是
A.同温同压下两种气体的体积之比等于摩尔质量之比 B.同温同压下两种气体的物质的量之比等于密度之比 C.同温同压下两种气体的摩尔质量之比不等于密度之比 D.同温同体积下两种气体的物质的量之比等于压强之比 3.对下列实验过程的评价,正确的是
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B.某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-
1.下列事故处理方法正确的是
A.汽油失火时,立即用水灭火 B.电线短路失火时,用大量的水灭火
C.浓NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D.浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
21.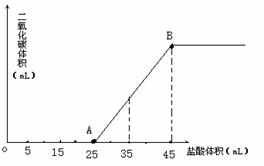 (14分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(14分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(1)写出OA段所发生反应的离子方程式:
;(4分)
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况)。(4分)
(3)计算原混合物中Na2CO3的质量分数为。(6分)
20.(14分)某学生按图示方向将A装置与下面所示装置相连,设计如下实验,请帮助完成实验报告。

㈠ 实验目的:研究铁与浓硫酸的反应
㈡ 实验药品:铁钉、浓硫酸、酸性高锰酸钾溶液、品红溶液、氧化铜、硫酸铜溶液
㈢ 实验步骤(将原因填入表中)
|
实验内容和步骤 |
实验现象 |
结论 |
|
① 连接好装置,并检查装置的气密性。 |
 |
 |
|
② 将铁钉加入到烧瓶中,再向其中滴加浓硫酸。 |
未见明显现象 |
原因:
|
|
③ 点燃A、G处酒精灯。 |
片刻后,烧瓶中溶液有颜色变化,并有气泡产生 |
原因:
|
㈣ 问题探究:
该学生在实验过程中,观察到D装置中溶液颜色逐渐变浅,E装置中溶液颜色未见明显变化,再过一段时间后,G装置中氧化铜粉末由黑色转变为红色,气球H逐渐鼓起,此时E装置中溶液颜色仍未明显变化。
⑴ G装置中氧化铜由黑变红,请结合化学方程式说明原因__
__ 。
⑵为证明铁钉与浓硫酸在不加热时是否发生反应,可采用的方法是____ _________
__ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com