
题目列表(包括答案和解析)
3、对以下几种物质进行除杂(括号内为杂质),请选择合适的试剂。
(1) CO2(CO),可选 。
(2) CO(CO2),可选 。
(3) NaOH溶液(Na2CO3),可选 。
(4) Cu(CuO),可选 。
|
第一章第1节 |
课题名称 |
化学实验的基本方法(一) |
||||
|
授课时间 |
第___周星期_____第____节 |
课型 |
习题课 |
主备课人 |
吕杨 |
|
|
学习目标 |
会做过滤、蒸发、蒸馏及物质的分离与提纯的相关基本题型 |
|||||
|
学习过程 与方法 |
自主学习: 《优化探究》第五、六页,第九页蒸馏部分 |
|||||
|
精讲互动: 1、课本课后习题 2、《优化探究》第7、8页活学活用 3、《优化探究》第8页基础巩固演练 |
||||||
|
达标训练: 高效作业(一) |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第1节 |
课题名称 |
化学实验的基本方法(二) |
||||
|
授课时间 |
第___周星期_____第____节 |
课时 |
第2课时 |
主备课人 |
吕杨 |
|
|
学习目标 |
掌握萃取、分液这两种物质分离方法的原理及适用范围 |
|||||
|
重点难点 |
重点:1、萃取、分液的原理与适用范围 2、物质的分离与提纯---常用的化学方法 难点:各种分离提纯方法的综合运用 |
|||||
|
学习过程 与方法 |
自主学习: 二、分离与提纯的基本方法 4、萃取:利用物质在 的溶剂中 的不同,将物质从一种溶剂转移到另一种溶剂中,从而进行分离的方法。萃取时,在液态混合物中加入的溶剂称为 。 选用的萃取剂必须符合下面两个条件: ① ② 5、分液是把 分离开的操作方法.例如,汽油与水的分离,就采用 方法加以分离.分液使用的仪器是 . 注意事项: ① 将要萃取的溶液和萃取溶剂依次从 口倒入分液漏斗,其量不能超过漏斗容积的 ,塞好塞子进行振荡。 ② 振荡时右手捏住漏斗上口的颈部,并用食指根部压紧塞子,以左手握住旋塞,同时用手指控制活塞,将漏斗倒转过来用力振荡。 ③ 然后将分液漏斗静置,待液体分层后进行分液,分液时下层液体从漏斗 口放出,上层液体从 口倒出。 6、升华:升华是指固态物质吸热后不经过液态直接变成气态的过程。利用某些物质具有升华的特性,将这种物质和其它受热不升华的物质分离开来,例如,加热使碘升华,来分离I2和SiO2的混合物。 |
|||||
|
精讲互动: 一、简述用四氯化碳萃取溴水里的溴的方法。 二、物质的分离与提纯------常用的化学方法 1. 沉淀法:即加入一种试剂和杂质反应生成沉淀经过滤而除去。 如:HNO3中混有H2SO4,可加入 2. 化气法:即加入一种试剂和杂质反应,使其生成气体而除去。如一般某盐中混有少量碳酸盐、碳酸氢盐等常用此法除去。 如:NaCl溶液中混有Na2CO3,可加入 3. 置换法:即在某盐溶液中加入某金属,把盐溶液中的金属置换出来,从而把杂质除去。如ZnSO4溶液中混有CuSO4,可加入 4. 转化法:即通过某种方法,把杂质转化为被提纯的物质。 如:CO2气体中混有少量的CO,可将混合气体通过盛有足量灼热的 的试管: 。 5. 加热法:即通过加热的方法使杂质转化为气体或使杂质分解变成气体而除去。 如:CuO中混有少量的木炭粉,可把混合物放在氧气流中加热,使C转化为CO2气体而除去: 6. 吸收法:即把混合气体通过某溶液,使其中杂质被吸收。 如:CO中混有少量CO2,可将混合气体通入 ,CO2被吸收而除去: 思考:为什么最好不用Ca(OH)2溶液? 7. 溶解法:即往混合物中加入某种溶液将杂质溶解而除去。 如:Cu里混有少量CuO,可往其中加入 ,CuO溶解过滤而除去: |
||||||
|
达标训练: 1、指出分离下列各组混合物的操作方法 1) 分离AgCl和NaCl的混合物 2)从食盐水中得到较纯净的食盐固体 3) 分离NaCl和KNO3的混合物得到较纯净的KNO3 4) 分离酒精和水的混合物 5)分离NaCl和碘的固体混合物 6)分离CCl4和水的混合物 7)提取溴水中的溴 2、 除去NaCl溶液中混有的少量Na2CO3,应选择的试剂与操作方法是什么? 3、 加入下列哪种物质可以除去FeSO4溶液中混有的少量杂质CuSO4 ( ) A.Zn B.Fe C.Cu D.Mg 4、 若制取的H2中混有少量HCl气体和水蒸气,应先将气体通过 除去 ,再通过 即可。 |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第1节 |
课题名称 |
化学实验的基本方法(二) |
||||
|
授课时间 |
第___周星期_____第____节 |
课型 |
习题课 |
主备课人 |
吕杨 |
|
|
学习目标 |
学会利用萃取的相关知识解决问题 |
|||||
|
学习过程 与方法 |
自主学习: 《优化探究》第9页 |
|||||
|
精讲互动: 1、 《优化探究》第10页活学活用 2、 《优化探究》第10页基础巩固演练 |
||||||
|
达标训练: 《优化探究》高效作业(二) |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第2节 |
课题名称 |
物质的量 |
||||
|
授课时间 |
第___周星期_____第____节 |
课时 |
第1课时 |
主备课人 |
吕杨 |
|
|
学习目标 |
1、 认识物质的量是描述微观粒子集体的一个物理量,摩尔是物质的量的基本单位 2、 了解阿伏加德罗常数的涵义 3、初步学会物质的量与物质微粒数之间的简单计算 |
|||||
|
重点难点 |
重点:物质的量的概念 难点:物质的量的概念的理解,物质的量与物质微粒数的关系。 |
|||||
|
学习过程 与方法 |
自主学习: 一、物质的量 1、在化学上引入物质的量将 与 联系起来,符号为 ,单位为 (简称为 ,符号为 )。 2、阿伏加德罗常数是指 ,符号为 ,近似值为 。含阿伏加德罗常数个微粒的集合体为 。 二、物质的量与物质的微粒数之间的关系 1、物质的量n与物质的微粒数N之间的关系 。 2、1 mol HCl与1 mol H2O 所含分子个数是否相等?所含H原子个数是否相等? |
|||||
|
精讲互动: 一、判断下列说法是否正确。 (1)物质的量就是物质的质量。( ) (2)1 mol西瓜。( ) (3)摩尔是常用的一个基本物理量。( ) (4)阿伏加德罗常数NA=6.02×1023 mol-1。( ) (5)阿伏加德罗常数NA约等于6.02×1023。( ) (6)阿伏加德罗常数NA在数值上约等于6.02×1023。( ) (7)1 mol任何物质中都约含有6.02×1023个粒子。( ) (8)1 mol H2O中含有2 mol氢和1 mol氧。( ) 总结: (1)物质的量是一个专有名词,不能理解为物质的数量或物质的质量,使用时不能有任何增减。 (2)物质的量只适用于微观粒子,不能用于宏观物体。如我们可以说1 mol H2O、2 mol电子,但我们绝不能说1 mol苹果、1 mol人。 (3)使用物质的量时,必须要用化学式指明微粒名称。如可以说1 mol H,1 mol H+,但不能说1 mol氧,1 mol氢。 (4)阿伏加德罗常数表示为NA,近似数值为6.02×1023,单位为 mol-1。 二、同一物质中,不同粒子的物质的量之间的关系 以H2O为例, 1个水分子中含有 个H、 个O,含有 个质子、 个电子. 6.02×1023个H2O中,则含有 个H、 个O,含有 个质子、 个电子 1 mol H2O中含有 mol H、 mol O、 mol 质子、 mol 电子. 小结: 练习: 计算下列物质的微粒数或物质的量。 (1)0.5 mol H2O中的水分子数 ,氢原子数 。 (2)1 mol Na2SO4中的Na +数 ,氧原子数 。 (3)1.204×1024个 H2SO4的物质的量 ,氧原子的物质的量 。 (4)6.02×1024个 H2SO4中的 H+数量与 mol HCl中的 H+数量相等。 总结:熟记N=n·.NA, n =N/ NA,,NA=N/ n是做好物质的量相关计算的关键。 |
||||||
|
达标训练: 1、下列说法正确的是( ) A、某物质含有6.02×1023个粒子,含有这个数目粒子的物质一定是1 mol。 B、1 mol H2SO4中含有2 mol氢和4 mol O。 C、1 mol H2O中约含有6.02×1024个电子。 D、物质的量就是物质的数量。 2、与 0.3 mol H2SO4中含有相同氢原子数的是( ) A、0.3 mol HCl B、0.1 mol H3PO4 C、3.612×1023个 HNO3 D、0.3 mol CH4 |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第2节 |
课题名称 |
物质的量 |
||||
|
授课时间 |
第___周星期_____第____节 |
课时 |
第2课时 |
主备课人 |
吕杨 |
|
|
学习目标 |
1、 理解摩尔质量的概念,能知道摩尔质量与相对原子质量、相对分子质量之间的关系 2、 弄清物质的量、摩尔质量、物质的质量之间的关系,会对有关概念进行计算 |
|||||
|
重点难点 |
重点:摩尔质量的概念和相关计算 难点:摩尔质量与相对原子质量、相对分子质量之间的关系 |
|||||
|
学习过程 与方法 |
自主学习: 一、 摩尔质量 1、____________________________________叫做摩尔质量,符号____,常用单位是__________或 。 2、规律:当物质的质量以克为单位时,摩尔质量在数值上都等于该物质的_____________。 3、物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间的关系: m = ; n = ; M = 4、铁的摩尔质量是 氧气的摩尔质量是 CO2的摩尔质量是 NaCl的摩尔质量是 SO42–的摩尔质量是 |
|||||
|
精讲互动: 一、讨论总结摩尔质量和相对原子/分子质量、原子质量之间的区别和联系。 二、在使用摩尔质量时应注意的事项: (1)摩尔质量与1 mol粒子的质量含义不同,但有一定的联系. 例如,H2SO4的摩尔质量为98 g·mol-1,1 mol H2SO4的质量是98 g. (2)当摩尔质量的单位取“g·mol-1”时,其数值与相对原子质量、相对分子质量或式量数值相等,但物理意义、单位都不同.在计算或使用时要注意区分. (3)对纯净物而言,其摩尔质量是固定不变的.例:M(CuSO4·5H2O)=250 g·mol-1 离子的摩尔质量的表示方法为:M(OH-)=17 g·mol-1 , M(Fe3+)=56 g·mol-1 三:例题解析 见课本第8页例题
2H2 + O2 = 2H2O 各物质的质量之比: 各物质的物质的量之比: 各物质的分子数之比: 各物质前的化学计量数之比: 小结: |
||||||
|
达标训练: 1、 下列有关摩尔质量的描述或应用中,正确的是( ) A.1 mol OH- 的质量为17g B.二氧化碳的摩尔质量为44g C.金属铁的摩尔质量等于它的相对原子质量 D. 2mol金属钠的质量等于46g.mol-1 2、0.5mol H2SO4的质量是 ,氧原子的物质的量为 ; 34g NH3的物质的量是 1.204×1023个CO2分子的质量是 1个氧原子的质量大约是 3、相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( ) ①它们所含的分子数目之比为1:1 ②它们所含O原子数目之比为1:2 ③它们所含的原子总数目之比为2:3 ④它们所含的C原子数目之比为1:1 ⑤它们所含的电子数目之比为7:11 A、①④ B、②③ C、④⑤ D、①②③④⑤ 4、19g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是____,A的相对原子质量是______,ACl2的化学式是______。 |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第2节 |
课题名称 |
物质的量 |
||||
|
授课时间 |
第___周星期_____第____节 |
课型 |
习题课 |
主备课人 |
吕杨 |
|
|
学习目标 |
1.物质的量相关概念题及物质的量与阿伏伽德罗常数的相关计算 2.摩尔质量相关计算 |
|||||
|
学习过程 与方法 |
自主学习: 《优化探究》第11页 |
|||||
|
精讲互动: 1、《优化探究》第12页活学活用 2、《优化探究》第12页基础巩固演练 |
||||||
|
达标训练: 高效作业(三) |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第2节 |
课题名称 |
气体摩尔体积 |
||||
|
授课时间 |
第___周星期_____第____节 |
课时 |
第3课时 |
主备课人 |
吕杨 |
|
|
学习目标 |
1、 掌握固、液、气态物质的一些性质 2、 理解气体的体积与温度和压强有密切的关系的基础上,理解气体摩尔体积的概念 |
|||||
|
重点难点 |
理解气体摩尔体积的概念 |
|||||
|
学习过程 与方法 |
自主学习: 1、物质的聚集状态主要有 、 、 ,在不同的温度和压强下,物质可以呈现 的状态。 2、从微观上考察,物质是 、 或 的聚集体。 3、日常生活中哪些物质存在不同的聚集状态? 4、当外界条件温度和压强一定时,物质的体积主要由物质 、 和 决定。 5、气体的摩尔体积(Vm) (1)定义 : (2)符号: (3)单位 (4)定义式: 注意事项 (1) 气体的摩尔体积研究对象是气体,可以是纯气体或者是混合气体,但不是固体或液体; (2) 研究气体的体积时必须标明温度和压强; (3) 气体的摩尔体积有无数个数值,在标准状况下 Vm =22.4 L/mol |
|||||
|
精讲互动: 1、(判断正误) ①、33.6 L H2 的物质的量是1.5 mol ②、标准状况下,1 mol H2O的体积是22.4 L ; ③、在一定的温度、压强下,1 mol某气态物质的体积约为22.4 L ,则该状态一定是、标准状况 2、如果用V 表示气体的体积,n 表示气体的物质的量,Vm 表示气体的摩尔体积,他们之间存在的等量关系是什么? 3、标准状态下,0.1 mol H2的体积是多少? 4、标准状态下,44.8 L CO2 的物质的量是多少?质量是多少? 5、标准状态下,一定量的 CO2 中含6.02×1023 个氧原子,则 CO2 得体积是多少? 注意事项:运用n = 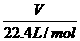 必须满足的两个条件:①气体;②标准状况,而 n= 必须满足的两个条件:①气体;②标准状况,而 n=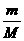 = = 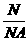 则是在任何条件下都成立。 则是在任何条件下都成立。 |
||||||
|
达标训练: 1、 下列说法正确的是( ) A. 1mol O2和1mol H2所占的体积都约为22.4 L B. 在标准状况下,1molH2和1mol H2O所占的体积都约为22.4 L C. 常温常压下,11.2 L氧气所含的原子数为NA D. 在标准状况下,22.4 L N2中所含电子数为14 NA 2、在标准状况下,至少需要多少体积的氢气与足量的氧气反应才能生成18g水? |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第2节 |
课题名称 |
气体摩尔体积 |
||||
|
授课时间 |
第___周星期_____第____节 |
课型 |
习题课 |
主备课人 |
吕杨 |
|
|
学习目标 |
学会用气体摩尔体积等概念进行简单的计算 |
|||||
|
学习过程 与方法 |
自主学习: 《优化探究》第13页 |
|||||
|
精讲互动: 《优化探究》14、15页活学活用 《优化探究》15页基础巩固演练 |
||||||
|
达标训练: 高效作业(四) |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第2节 |
课题名称 |
溶液的配制及分析(一) |
||||
|
授课时间 |
第___周星期_____第____节 |
课时 |
第4课时 |
主备课人 |
吕杨 |
|
|
学习目标 |
1、
掌握有关物质的量浓度的简单计算 2、 通过计算掌握物质的量、溶液体积和物质的量三者的关系,能够用物质的量浓度处理具体问题 3、 掌握物质的质量分数和物质的量浓度之间的换算 |
|||||
|
重点难点 |
物质的量浓度及相关计算 |
|||||
|
学习过程 与方法 |
自主学习: 1、物质的量浓度是________________________________________________。 符号为 _____ ,常用的单位是 _________。公式为 ____________。 2、练习: (1)将20 g的NaOH 固体溶于水配成500 mL的溶液,该溶液的物质的量浓度为 (2)欲配制1 mol·L-1的CuSO4溶液100 mL,需要胆矾(CuSO4 · 5H2O)的质量为 g |
|||||
|
精讲互动: 1、在标准状况下,将V L气体A(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为d g·mL-1,则此溶液中溶质的物质的量浓度为( ) A.  mol·L-1 B. mol·L-1 B. 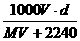 mol·L-1 mol·L-1C. 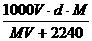 mol·L-1 D. mol·L-1 D.
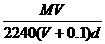 mol·L-1 mol·L-12、100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为 ( ) A. 0.20 mol·L-1 B. 0.40 mol·L-1 C. 0.25 mol·L-1 D. 0.50 mol·L-1 3、1 L 2mol/L的MgCl2溶液中,Mg2+ 和Clˉ的物质的量分别是 、 Mg2+ 和Clˉ的物质的量浓度分别是___ __ 、______ ___ 4、1 L 3 mol/L的NaCl溶液,从其中取出10 mL,则这10 mL溶液的物质的量浓度为 如果将这10 ml溶液加水稀释至1 L,这1 L溶液的物质的量浓度为 总结:对溶液进行稀释的时候根据稀释前后溶液中溶质的物质的量不发生变化,也就是; 根据公式: c(稀) × V(稀)= c(浓)× V(浓) 5、有关物质的量浓度与溶液中溶质质量分数的换算 某溶液的密度为ρ g·mL-1,溶质的摩尔质量为M g·mol-1,溶质的质量分数为ω,则该溶液的物质的量浓度为 特别提示:注意各物理量的单位。 |
||||||
|
达标训练: 1. 在100 mL,0.1mol·L-1的NaOH溶液中,所含的NaOH的质量为( ) A. 40g B. 4g C. 0.4g D. 0.04g 2、下列说法不正确的是( ) A.把58.5g NaCl固体溶进1L水中,所得NaCl溶液的物质的量浓度时1 mol/L B.把58.5g NaCl固体溶进水得到1L溶液,所得NaCl溶液的物质的量浓度为1 mol/L C.标准状况下,把2.8L HCl溶于水,制成100ml溶液其物质的量浓度为1.25 mol/L D.1000ml 2.5 mol/L的NaCl溶液Cl-的物质的量浓度小于250ml 5 mol/L的AlCl3中Cl-的浓度 3. 下列溶液中的Cl-浓度与50 mL 1 mol·L-1的AlCl3溶液中Cl-的浓度相等的是( ) A. 150 mL 1 mol·L-1的NaCl B. 75 mL 2 mol·L-1的NH4Cl C. 150 mL 2 mol·L-1的KCl D. 75 mL 1.5 mol·L-1的CaCl2 4. 在V L硫酸铝溶液中,含有W g Al3+,这种溶液中SO42-的物质的量浓度是( ) A. 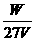 B. B.
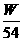 C. C.
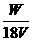 D. D.
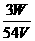 5、市售浓硫酸中溶质的质量分数是98%,密度是1.84 g/cm3,计算该浓硫酸的物质的量浓度是多少? |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第2节 |
课题名称 |
物质的量浓度 |
||||
|
授课时间 |
第___周星期_____第____节 |
课型 |
习题课 |
主备课人 |
吕杨 |
|
|
学习目标 |
溶液配制相关计算及误差分析题 |
|||||
|
学习过程 与方法 |
自主学习: 《优化探究》第15页 |
|||||
|
精讲互动: 1、 《优化探究》第16、17页活学活用 2、 《优化探究》第117页基础巩固演练 |
||||||
|
达标训练: 《优化探究》高效作业(五) |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第2节 |
课题名称 |
溶液的配制及分析(二) |
||||
|
授课时间 |
第___周星期_____第____节 |
课时 |
第5课时 |
主备课人 |
吕杨 |
|
|
学习目标 |
1、 掌握容量瓶的使用方法。 2、 初步学会配制一定物质的量浓度溶液的方法和操作技能。 3、 初步学会溶液配制过程的误差分析。 |
|||||
|
重点难点 |
重点:一定物质的量浓度溶液的配制方法和操作技能。 难点:溶液配制过程的误差分析。 |
|||||
|
学习过程 与方法 |
自主学习: 二、容量瓶 1、配制一定物质的量浓度的溶液时,需要准确控制溶液的 ,实验室使用 来配制一定体积、一定浓度的溶液。 2、容量瓶由 和 两部分组成。瓶身上有三个需要注意的标记,分 别是 、 和 。容量瓶不能用作 或 的容器,热的溶液需 才能转移到容量瓶中。 3、容量瓶使用之前一定要先 。 三、配制一定物质的量浓度的溶液(资料 P32 ) 1、 所用仪器: 2、 配制步骤: → → → → → → → → |
|||||
|
精讲互动: 一、误差分析 根据公式cB=nB/V,请思考以下操作对配制一定体积,一定物质的量浓度的溶液的浓度有什么影响,用以下三个选项回答。 (A. 无影响 B. 浓度偏小 C. 浓度偏大) ①容量瓶事先用蒸馏水洗剂,没有干燥就进行实验。( ) ②称量溶质时,托盘天平左右托盘的物品放反。( ) ③用玻璃棒搅拌溶解溶质时,用力过猛,一部分液体溅出烧杯。( ) ④转移时,少量液体溅出容量瓶。( ) ⑤转移完毕后,没有洗涤操作直接加水定容.( ) ⑥定容时加水不小心超过刻度线,立即用胶头滴管将多余液体吸出。( ) ⑦定容后对容量瓶内溶液上下颠倒摇匀,发现凹液面低于刻度线。( ) ⑧当摇匀后凹液面低于刻度线,立即加水至凹液面与容量瓶刻度线相切。( ) ⑨配制50 mL 1 mol·L-1的NaCl溶液,事先用1 mol·L-1的NaCl溶液润洗50 mL的容量瓶。( ) ⑩配制NaOH溶液时,溶解后,未冷却将较浓的NaOH溶液转移入容量瓶。( ) 11定容时俯视观察液面。( ) 12定容时仰视观察液面。( ) 总结:1. 误差分析的关键是把握公式:cB=nB/V, nB 偏小则cB偏小,反之偏大;V偏小则cB偏大,反之偏小。 2. 配制一定体积的溶液一定要注意容量瓶的规格。(460 mL的体积只能选500mL的容量瓶) |
||||||
|
达标训练: 1、 精确配制250mL一定物质的量浓度的氢氧化钠溶液,下面的实验操作中正确的是( ) A.选择容量瓶时,选用500mL的容量瓶 B.称量时,将氢氧化钠固体直接放在托盘天平的纸上 C.将称好的氢氧化钠固体放入容量瓶中,加少量水溶解 D.在烧杯中溶解氢氧化钠后,立即将所得溶液注入容量瓶中 E.将烧杯中的氢氧化钠溶液注入未干燥的容量瓶中 2、实验室里需用480 mL 0.1 mol·L-1的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是( ) A、称取7.68g硫酸铜,配成500 mL溶液 B、称取12.0g胆矾,加入500 mL水 C、称取8.0g硫酸铜,配成500 mL溶液 D、称取12.5g胆矾,配成500 mL溶液 3、.配制一定物质的量浓度的NaOH溶液的误差分析 (填不变.偏高.偏低) A 在托盘天平上称取12.4gNaOH时,误将砝码放在天平的左盘上 B 称取的NaOH 已经潮解 C 溶质溶解时放热,溶解后将溶液迅速地转移到容量瓶,洗涤,定容 D 转移时,将NaOH 液滴掉在容量瓶外 E 配制时,未将洗涤液转移到容量瓶中 F 定容时,未将水滴加到标线 G 定容时俯视 H 定容时,盖好瓶塞反复摇匀,发现液面低于标线,再加蒸馏水使液 面达到刻度处 I 配制好的溶液,从容量瓶转移到干燥洁净的试剂瓶中,有少量溶液溅出 |
||||||
|
课堂小结 |
|
|||||
|
作业布置 |
|
|||||
|
课后反思 |
|
|||||
|
第一章第1-2节 |
课题名称 |
第一章1-2节复习课 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
授课时间 |
第___周星期_____第____节 |
课型 |
复习课 |
主备课人 |
吕杨 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
重点难点 |
混合物的分离与提纯;离子的检验 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
学习过程 与方法 |
自主学习: 1、 混合物的分离与提纯:
2、用Na2CO3,、BaCl2和HCl溶液作试剂,除去NaCl溶液中含有的少量Ca2+ 和SO42-,每种试剂不能重复使用,提纯过的溶液中除了Na+ ,Cl-, H+ 和OH-外,不能有任何其他离子,加入试剂的顺序为( ) A、Na2CO3 HCl BaCl2 B、BaCl2 HCl Na2CO3 C、Na2CO3 BaCl2 HCl D、BaCl2 Na2CO3 HCl 23.(1)2.0 小烧杯 (2)C、H (3)玻璃棒 溶解NaOH时,搅拌加速NaOH溶解 转移溶液时,引流,防止液体溅失。 (4)①④ 24、(1)S8 (2)S6 (3)S4 25(1)0.050 mol(2)33.3mL (3)1.50 mol /·L (4)30.4 mL 22.(1)氯水(或双氧水、稀硝酸等合理氧化剂) 现象:或溶液由浅绿色变为血红色 (2)将Fe2+全部氧化为Fe3+ (3)Fe3++3OH-→Fe(OH)3↓(或Fe3++3NH3·H2O→Fe(OH)3+3NH4+) (4)洗涤、冷却 (5)0.07a (6)①250mL容量瓶 ②b ③紫(或紫红) (7)69.5mg 21.(1)c = 4g+10h (2)c-b=2d+3f (3)2d+3f=3g+8h (4)6<b<12 30<c<48 25.(12分)常温下,在28.9g水中溶解12.1g Cu(NO3)2·3H2O,恰好达到饱和,设该溶液 密度为1.20g /cm3,求:(1)该溶液中Cu(NO3)2的物质的量 (3分) (2)溶液的体积(3分) (3)该溶液中Cu(NO3)2的物质的量浓度(3分) (4)取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?(3分)
24. (6分)硫通常是一种淡黄色晶体,它的蒸气有橙色、无色、红棕色三种,它们都是硫的单质,但是每个分子中硫原子的个数不同,可用SX表示,对三种蒸气测定的结果是: (1)橙色蒸气的密度折算成标准状况后是11.34克/升,它的分子式为: (2)红棕色蒸气的质量是相同状况下同体积空气的6.62倍,则它的分子式为: (3)无色蒸气的密度是同状况下氢气密度的64倍,则它的分子式为: 23.(10分)实验室用固体烧碱配制500 mL 0.1 mol·L―1的NaOH溶液。 (1)(2分)需称量_______ _g烧碱固体,它应该放在_______ _中进行称量。 (2)(2分)配制过程中,不需要使用的仪器是(填写代号)________。 A.烧杯 B.量筒 C.1000 mL容量瓶 D.托盘天平 E.药匙 F.500 mL容量瓶 G.胶头滴管 H.漏斗 (3)(3分)除上述可使用的仪器,还缺少的仪器是______ ___,它在实验中的作用为 _____________ ___。 (4)(3分)要配制浓度约为2 mol·L―1 NaOH溶液100 mL,下列操作正确的是________。 ①称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加 入烧杯中,同时不断搅拌至固体溶解。 ②称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完 全溶解后用蒸馏水稀释至100 mL。 ③称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体 溶解,再加水至刻度线,塞好瓶塞,反复摇匀。 ④用100 mL量筒量取40 mL 5 mol·L―1 NaOH,倒入250 mL烧杯中,再用同一量筒 量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中。 21.(15分)单质铁溶于一定浓度的硝酸中反应的化学方程式如下: a Fe+bNO3-+cH+=d Fe2++f Fe3++g NO↑+h N2O↑ +kH2O (化学计量数均为正整数) (1)c、g、h 的关系式是 _________________(2)b、c、d、f 的关系式是 __ _____ (3)d、f、g、h 的关系式是 ___________________________ (4)若a =12 ,铁和硝酸恰好完全反应,则b 的取值范围是 _ __ c的取值范围是 __ _
|
请回答下列问题:
(1)(2分)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,
该过程的现象为:
(2)(2分)步骤②加入过量H2O2的目的: 。
(3)(2分)步骤③中反应的离子方程式: 。
(4)(2分)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)(3分)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)(4分)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 (1分)
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。(2分)
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。(1分)
(7)(2分)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂
来补充铁,则正常人每天服需用含 mgFeSO4·7H2O的片剂。
20.将含1mol HCl的稀盐酸,逐滴加入含0.2 mol NaOH和0.5 molNa2CO3的混合溶液中,充分反应后溶液中各物质的量是
|
|
HCl/mol |
NaCl/mol |
NaOH/mol |
Na2CO3/mol |
NaHCO3/mol |
|
A |
0 |
1 |
0.1 |
0 |
0.1 |
|
B |
0 |
1 |
0 |
0.1 |
0.1 |
|
C |
0.2 |
0.8 |
0 |
0 |
0.2 |
|
D |
0 |
1 |
0 |
0 |
0.2 |
请将选择题的正确答案填入以下表格中(每小题3分,共 60分 )
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com