
题目列表(包括答案和解析)
30、分子式为C2H6O的化合物A具有如下性质:

(1)根据上述信息,对该化合物可作出的判断是 。
A、一定含有-OH B、一定含有-COOH
C、A为乙醇 D、A为乙酸
(2)含A的体积分数为75%的水溶液可以用作 。
(3)A与钠反应的化学方程式: 。
(4)A可由含淀粉[(C6H10O5)n]的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制A的化学方程式: 。
29、W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为 。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
。
(4)比较Y、Z气态氢化物的稳定性: > (用分子式表示)。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是 > >
> 。
28、A、B、C三种有机物均由碳、氢、氧三种元素组成,物质A能溶于水,它的式量是60,分子中有8个原子,其中氧原子数与碳原子数相等,A能与Na2CO3反应。B分子中有9个原子,分子内原子的核电荷数之和为26,1 mol B 充分燃烧时需消耗3 mol O2。C是B的同系物,其摩尔质量与O2相同,C可与钠反应生H2。问A、B、C各是什么物质?(要求写步骤)
27、对于可逆反应aA(g)+bB(g)  cC(g)+dD(g),取a mol A和b mol B,置于容积为V的容器中,1min后,测得容器内A的浓度为x mol·L-1。请回答下列问题。(不要求写步骤)
cC(g)+dD(g),取a mol A和b mol B,置于容积为V的容器中,1min后,测得容器内A的浓度为x mol·L-1。请回答下列问题。(不要求写步骤)
(1)这时B的浓度为
(2)C的浓度为
(3)这段时间内反应的平均速率若以物质A浓度变化来表示,应为
26、糖尿病是“富贵病”,请你设计实验检验病人尿液中的葡萄糖,并与正常人作对比,设计要求:(1)写出实验所用化学药品。
(2)写出实验现象并作出结论。
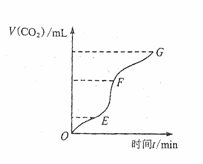
25、用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断: 段化学反应速率最快, 段收集的二氧化碳最多。
(2)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
A、蒸馏水 B、NaCl固体 C、NaCl溶液 D、浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?
24、“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。
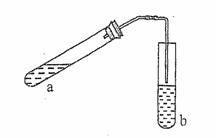
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式 。
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是
。
(3)浓硫酸的作用是:① ;②
。
(4)饱和碳酸钠溶液的主要作用是① ;
② ③
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是
。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1 mol乙酸乙酯,同时生成1 mol水 ②单位时间里,生成1 mol乙酸乙酯,同时生成1 mol乙酸 ③单位时间里,消耗1 mol乙醇,同时消耗1 mol乙酸 ④正反应的速率与逆反应的速率相等 ⑤混合物中各物质的浓度不再变化
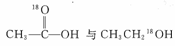
(9)反应时,可能生成的物质是( )
A、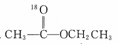 B、
B、
C、H218O D、H2O
23、如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
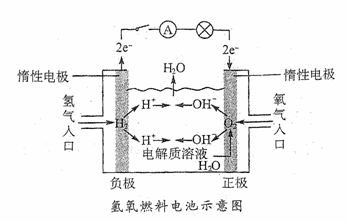
(1)酸式电池的电极反应:负极 ,正极 ;电池总反应: ;电解质溶液pH的变化 (填“变大”“变小”或“不变”)。
(2)碱式电池的电极反应:负极 ,正极 ;电池总反应: ;电解质溶液pH的变化 (填“变大”“变小”或“不变”)。
24、(5)标准状况时乙烷与某烃的混合气1.344L与足量O2混合点燃,充分反应后,将所得气体通入300mL 0.4mol/LNaOH溶液中完全吸收。将此溶液于低温下蒸干,得到不含结晶水的固体7.6g,试推算原混合气中两种气体的体积分数。
2009-2010学年第二学期周口市部分重点高中联考
23、(10分)某课外实验小组利用稀硫酸与金属铁反应探究影响化学反应速率的因素,得到如下实验数据:分析有关数据,回答下列问题:
(1)实验2和3表明, 对反应速率有影响,影响规律是
|
实验序号 |
铁的质量/g |
铁的形态 |
c/(H2SO4)/mol·L-1 |
V(H2SO4)/mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
铁片 |
0.7 |
50 |
20 |
36 |
250 |
|
2 |
0.10 |
铁片 |
0.8 |
50 |
20 |
35 |
200 |
|
3 |
0.10 |
铁粉 |
0.8 |
50 |
20 |
36 |
25 |
|
4 |
0.10 |
铁片 |
1.0 |
50 |
20 |
35 |
125 |
|
5 |
0.10 |
铁片 |
1.0 |
50 |
35 |
50 |
50 |
;
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,能体现该影响因素的实验序号是 ;
(4)在实验4中滴入几滴硫酸铜溶液,金属消失的时间小于125s。
原因是
;
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,试从反应过程能量的变化角度推测其原因
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com