
题目列表(包括答案和解析)
1.“朝核危机”已引起全球关注,其焦点是朝鲜核电站采用轻水反应堆还是重水反应堆。重水反应堆核电站在发电的同时还可以生产出可供研制核武器的钚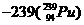 ,这种
,这种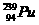 可由铀
可由铀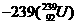 经过多次β衰变而得,下列有关
经过多次β衰变而得,下列有关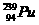 与
与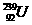 的说法中正确的是
的说法中正确的是
A.二者互为同位素 B.二者具有相同的质子数
C.二者具有相同的质量数 D.二者具有相同的中子数
22.(11分)(2010·临沂模拟)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO、Ba2+、SO.将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
|
实验 序号 |
实验内容 |
实验结果 |
|
1 |
加AgNO3溶液 |
有白色沉淀生成 |
|
2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
|
3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1-3判断混合物中一定不存在的离子是________.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol/L) |
|
|
|
|
|
|
|
|
|
(3)试确定K+是否存在?________,判断的理由是________________________________
______________________________________________________________.
解析:该混合物溶于水后得澄清溶液,说明Ba2和SO不能同时存在,加足量NaOH溶液并加热产生气体,说明存在NH,由1.12 L氨气可知,NH的物质的量为0.05 mol,在第三步操作中,沉淀有两种,说明存在SO和CO,则该混合物中不存在Ba2+,同时也不存在Mg2+.由沉淀的质量求出SO的物质的量为0.01 mol,CO的物质的量为0.02 mol,加AgNO3溶液有沉淀,并不能确定有Cl-,因为Ag+与SO和CO都能产生沉淀.根据离子所带的正、负电荷数相等可知,K+一定存在,但是K+的物质的量不能确定,因为Cl-是否存在并不明确.
答案:(1)不能确定 Ba2+、Mg2+
(2)
|
阴离子符号 |
物质的量浓度(mol/L) |
|
SO |
0.1 |
|
CO |
0.2 |
(3)存在 溶液中肯定存在的离子是NH、CO和SO.经计算,NH的物质的量为0.05 mol,CO、SO的物质的量分别为0.02 mol和0.01 mol,根据电荷守恒,得K+一定存在。
21.(8分)从氧元素的价态看,H2O2是一种特殊氧化剂;从产物看,H2O2是一种绿色氧化剂.
(1)已知下列反应在一定条件下可以发生:
H2O2+2Fe2++2H+===2Fe3++2H2O
H2O2+2Fe3+===2Fe2++O2↑+2H+
在以上反应中Fe2+实际上起着____________作用,总反应式为________________________________________________________________________.
(2)I2与Fe2+一样发生上述类似反应,类比(1)在下面填入配平的合适的化学方程式:H2O2+I2===2HIO,
______________________________________________________________________,总反应式为_____________________________________________.
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝,有学生认为该反应的离子方程式为:H2O2+2I-===I2+O2↑+2H+,这个方程式正确吗?________.
①若正确,理由是(若认为不正确,该步不必答)________________________;
②若不正确,原因是(若认为正确,该步不必作答)_______________________________
__________________,并写出正确的化学方程式(若是离子反应,写出离子方程式;没有离子反应的,写出化学方程式)______________________________________.
解析:(1)将两个反应相加,可以发现Fe2+在反应前后没有变化,只起到催化剂的作用.
(2)I2与Fe2+一样发生上述类似反应,说明I2也是反应的催化剂,即H2O2与HIO能反应生成I2.
(3)该离子方程式中只有化合价的升高,没有化合价的降低,不符合氧化还原反应的规律.
答案:(1)催化剂(或催化)
2H2O22H2O+O2↑
(2)2HIO+H2O2===I2+2H2O+O2↑
2H2O22H2O+O2↑
(3)不正确 氧元素和碘元素的化合价均上升,没有化合价降低的元素(或违背电荷守恒原理)
H2O2+2I-+2H+===2H2O+I2、2H2O22H2O+O2↑ www.k@s@5@ 高#考#资#源#网
20.(8分)对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.
(1)现有下列6种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2.按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①________________________________________________________________.
②___________________________________________________________________.
(2)从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式:____________________、____________________.
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系:________________________.
(4)生活中的食醋和淀粉溶液分属于分散系中的________和________,用__________可以鉴别(填化学专用名词).
解析:(1)根据物质的性质差别,找出分类的标准,即可分类.
(2)这些都是氧化物,写非氧化还原反应方程式可找碱性氧化物与酸性氧化物的反应;写氧化还原反应方程式,注意具有还原性和氧化性的物质.
(3)离子反应中有氧化还原反应和非氧化还原反应,氧化还原反应中有离子反应和有非离子反应,二者是交叉关系.
(4)食醋属于溶液,淀粉溶液属于胶体,二者可用丁达尔效应鉴别.
答案:(1)①SO2常温常压下是气体,其余是固体
②Na2O2是过氧化物,其余为酸性氧化物或碱性氧化物(答案不唯一,合理即可)
(2)CaO+SiO2CaSiO3(或MgO+SO2MgSO3等其他合理答案)
Na2O2+SO2===Na2SO4
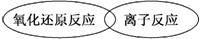 (3)
(3)
(意思正确、能表示二者的交叉关系即可)
(4)溶液 胶体 丁达尔效应
19.(8分)(2010·枣庄模拟)储氢纳米碳管的研制成功体出了科技的进步.用电弧法合成的碳纳米管常伴有大量的杂质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种.




 (1)请用上述物质填空,并配平化学方程式:
(1)请用上述物质填空,并配平化学方程式:
 C+ ________+ H2SO4=== __________+ __________+
C+ ________+ H2SO4=== __________+ __________+
 Cr2(SO4)3+ H2O
Cr2(SO4)3+ H2O
(2)上述反应中氧化剂是________(填化学式),被氧化的元素是________(填元素符号).
(3)H2SO4在上述反应中表现出来的性质是(填选项序号)________.
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为________.
解析:分析所给物质的化合价和反应的部分化学方程式可知,氧化剂为K2Cr2O7,还原产物为Cr2(SO4)3,还原剂为C,氧化产物为CO2.由C―→CO2、K2Cr2O7―→Cr2(SO4)3变化过程中得失电子守恒配平得3C+2K2Cr2O7+8H2SO4===3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O,H2SO4在反应中表现酸性.
由上述反应可知12e--3CO2,若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为0.2 mol×22.4 L/mol=4.48 L.
答案:(1)3 2K2Cr2O7 8 3CO2 2K2SO4 2 8
(2)K2Cr2O7 C (3)C (4)4.48 L
18.(8分)(1)从C、H、O、N四种元素中选择适当的元素,组成符合下列要求的物质,将其化学式填入空格内.
①可作清洁无污染的燃料的单质是________.
②冶金工业中常用来作还原剂的氧化物是________.
③常用的两种氮肥,其中一种属于酸式盐,另一种是正盐,且它们的组成元素不完全相同,则它们分别为__________和__________.
(2)将a mol Cl2通入b mol FeBr2的溶液中,当0<a/b≤1/2时,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-,写出另2个可能发生反应的离子方程式:
①当a/b=1时____________________________________.
②当a/b≥3/2时_______________________________________________.
解析:Fe2+和Br-都有还原性,都能和Cl2反应,但还原性Fe2+>Br-,Cl2先氧化Fe2+,故可写出(2)的离子方程式.
答案:(1)①H2 ②CO ③NH4HCO3 NH4NO3
(2)①2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
②2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
17.(9分)(2009·厦门模拟)“探险队员”--盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过.
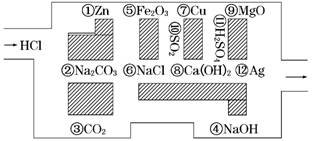
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)________________.
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有__________个,属于氧化还原反应的有__________个,其中能“吃掉”盐酸的盐是__________,写出该反应的离子方程式________________________________________________.
(3)在不能与盐酸反应的物质中,属于电解质的是__________(填写物质序号),属于非电解质的是________.
(4)如果将盐酸换成氯气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?
______________________________________________________________________.
解析:(1)图中物质③、⑥、⑩、⑦、⑪、⑫均不与盐酸反应,沿该路线可走出迷宫.
(2)盐酸与NaOH、Ca(OH)2的反应属于酸和碱的中和反应,与Zn的反应属于氧化还原反应,能“吃掉”盐酸的盐是Na2CO3,该反应的离子方程式为CO+2H+===CO2↑+H2O.
(3)在不能与盐酸反应的物质中,属于电解质的是H2SO4、NaCl,属于非电解质的是CO2、SO2.
(4)如果将盐酸换成氯气,它沿着盐酸走出的路线不能“走出”这个迷宫,因为氯气有强氧化性,遇到二氧化硫、铜时都会发生氧化还原反应从而被“吃掉”.
答案:(1)③⑥⑩⑦⑪⑫
(2)2 1 Na2CO3 CO+2H+===CO2↑+H2O
(3)⑥⑪ ③⑩
(4)不能,因为氯气有强氧化性,遇到二氧化硫、铜时都会发生氧化还原反应从而被“吃掉”
16.有Fe2+、NO、Fe3+、NH、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是 ( )
A.氧化剂与还原剂的物质的量之比为1∶8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化 www.k@s@5@ 高#考#资#源#网
C.若有1 mol NO发生氧化反应,则转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-===Fe3+
解析:上述离子发生氧化还原反应,氧化剂为NO,还原剂为Fe2+,反应方程式为8Fe2++NO+10H+===8Fe3++NH+3H2O,A项,氧化剂与还原剂物质的量之比为1∶8,正确;B项,NO在酸性条件下体现氧化性,正确;C项,1 mol NO发生还原反应,转移8 mol e-,错误;D项正确.
答案:C
15.(2009·浙江十校联考)在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO、OH-6种离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是 ( )
A.Cu2+、H+、Cl- B.CO、OH-、Cl-
C.K+、H+、Cl- D.K+、OH-、CO
解析:甲烧杯的溶液呈蓝色,说明甲烧杯中有Cu2+,则甲烧杯中没有CO、OH-;那么乙烧杯中有CO、OH-,没有H+,而剩下的阳离子只有K+,则乙中一定有K+.
答案:D
14.赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S6Cu+SO2↑,对于该反应,下列说法正确的是 ( )
A.该反应的氧化剂只有Cu2O
B.Cu既是氧化产物,又是还原产物
C.Cu2S在反应中既是氧化剂又是还原剂
D.还原产物与氧化产物的物质的量之比为1∶6
解析:根据反应方程式,标出发生变化的元素的化合价:
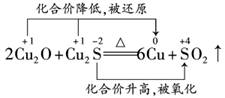
可以看出Cu2O和Cu2S中Cu的化合价均降低,因此二者均为氧化剂,产物中的Cu来源于+1价Cu,只为还原产物,A、B错误.Cu2S中的Cu化合价降低,S化合价升高,因此Cu2S既是氧化剂又是还原剂,C正确.反应中还原产物为Cu,氧化产物是SO2,二者的物质的量之比为6∶1,D错误.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com