
题目列表(包括答案和解析)
3.下列各组微粒具有相同质子数和电子数的是 ( )
A.H3O+、NH4+、Na+、HF B.OH-、F-、O2-、Ne
C.CH4、NH3、H2O、HF D.O2-、F-、Mg2+、Al3+
2.某气体水溶液呈酸性,该气体能使酸性高锰钾溶液褪色,也能使品红褪色,该气体是
A.HBr B.CO2 C.SO2 D.H2S
1.保护环境是每一个公民的责任。下列做法:①推广使用无磷洗涤剂,②城市生活垃圾分类处理,③推广使用一次性木质筷子,④推广使用清洁能源,⑤过量使用化肥、农药,⑥推广使用无氟冰箱。其中有利于保护环境的是 ( )
A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
26、(10分) 某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究] Ⅰ.定性检验
|
编号 |
实验操作 |
实验现象 |
|
① |
取少量黑色粉末X放入试管1中,注入浓盐酸,微热 |
黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
|
② |
向试管1中滴加几滴KSCN溶液,振荡 |
溶液出现血红色 |
|
③ |
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 |
有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生反应的离子方程式为 ▲ 。
(2)上述实验说明黑色粉末X中含有 ▲ 。
Ⅱ.定量测定
根据下图所示的实验方案进行实验并记录数据:

(1) 操作Z的名称是 ▲ 。
(2) 通过以上数据,得出14.40g黑色粉末X中各成分的物质的量为 ▲ mol。
(3) 若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)= ▲ mol/L。
25、(6分)下表标出的是元素周期表的一部分元素,回答下列问题:
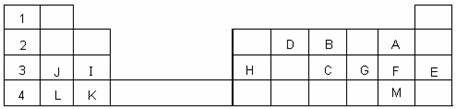
(1)表中用字母标出的13种元素中,化学性质最不活泼的是 ▲ (用元素符
号表示,下同),金属性最强的是 ▲ 。
(2)F的最高价氧化物对应的水化物的化学式为 ▲ 。
(3)D的最高价氧化物的电子式为 ▲ ;
B的氢化物与其最高价氧化物对应的水化物反应的化学方程式为 ▲ 。
24、 ( 5分+ 5分 + 5分 = 15分 )
( 5分+ 5分 + 5分 = 15分 )
(1) 如右图所示,负极材料是 ▲ ,
正极的电极反应式为 ▲ ,
电池工作时总反应的离子方程式是 ▲ 。
(2) ①淀粉水解的最终产物是 ▲ (写化学式),乙酸乙酯中混有少量乙酸杂质,除杂的
试剂最好选用 ▲ 。
②工业上用 ▲ 法制备金属铝,用化学方程式表示为 ▲ 。
(3) 为探究化学反应速率和化学反应限度的有关问题,某研究小组以H2O2的分解反应为研究对象进行实验,实验方案和数据记录如下表,t表示收集a mLO2所需的时间。
|
序号 |
反应温度/℃ |
c (H2O2)/mol·L-1 |
V(H2O2)/mL |
m(MnO2)/g |
t/min |
|
1 |
20 |
2 |
10 |
0 |
t 1 |
|
2 |
20 |
2 |
10 |
0.1 |
t 2 |
|
3 |
20 |
4 |
10 |
0.1 |
t 3 |
|
4 |
40 |
2 |
10 |
0.1 |
t 4 |
① H2O2分解反应的化学方程式为 ▲ ;
②设计实验2和实验3的目的是研究 ▲ 对化学反应速率的影响;
③为研究温度对化学反应速率的影响,可以将实验 ▲ 和实验 ▲ (填序号)作对比;
④将实验1和实验2作对比,t1 ▲ t2(填“>”“<”或“=”)
23、碳酸铜CuCO3和碱式碳酸铜Cu2(OH)2CO3均可溶于盐酸,转化为氯化铜;在高温下
这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,消耗1mol/L盐酸500mL。
灼烧等质量的上述混合物,得到氧化铜的质量是[
A. 20 g B.30 g C. 35g D.15 g
请将选择题答案填涂在机读答题卡上
22、下列有关说法中不正确的是
A.工业上可利用海水制取镁
B.实验室可用海带为原料获得碘
C.工业上可用还原剂还原赤铁矿(含Fe2O3)获得铁
D.从海水中提取溴元素(以Br-形式存在),可以考虑向其中通入F2
21、氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法不正确的是
A.该电池工作时化学能转化为电能
B.该电池中电极b是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H2+O2 = 2H2O
20、 元素X的最高正价和最低负价的绝对值之差为4,Y元素的离子与X元素的离子具有相同的电子层结构,则X、Y形成的化合物可能是
元素X的最高正价和最低负价的绝对值之差为4,Y元素的离子与X元素的离子具有相同的电子层结构,则X、Y形成的化合物可能是
A.MgO B.KCl C.NaF D.K2S
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com