
题目列表(包括答案和解析)
5.Na和Na+两种微粒中,不相同的是( )
①核内质子数②核外电子数③最外层电子数④核外电子层数
A ①② B ②③ C ③④ D ②③④
4.2005年6月5日是第34个世界环境日,我国环保总局确定的主题是“人人参与,创建绿色家园”。下列措施不符合这一主题的是 ( )
A.推广垃圾分类存放,分类回收,分类处理
B.改革传统采煤时将煤层气(瓦斯气,主要成分甲烷)直接排入空气的做法,采用先开采和综合利用煤层气,然后再采煤的方法
C.推荐使用手帕,尽量减少使用面纸
D.将工厂的烟囱造高,以减少工厂周围的大气污染
3.与OH-具有相同质子数和电子数的粒子是:( )
A.F-
B.Cl- C. NH3
D.NH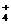
2. 1992年,我国取得重大科研成绩之一是发现了三种元素的新的同位素,其中一种是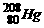 。下列关于
。下列关于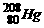 的叙述中,错误的是( )
的叙述中,错误的是( )
A.质子数是80 B.电子数是80 C.中子数是80 D.质量数是208
1. 19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子学说 B. 发现元素周期律
C. 提出分子学说 D. 发现氧气
22、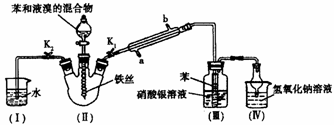 (10分)某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:
(10分)某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:
(1)冷凝管所起的作用为冷凝回流和_______,冷凝水从________口进入(填“a或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。Ⅲ中小试管内苯的作用是___________.
(3)能说明苯与液溴发生了取代反应的现象是____________.
(4)反应结束后,要让装置I中的水倒吸入装置Ⅱ中。这样操作的目的是_____________,简述这一操作的方法: .
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液; ②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液; ④加入无水CaCl2粉末干燥;
⑤ (填操作名称)
21、 (8分)一定温度下,在容积为1L的密闭容器中进行反应:aN(g)
(8分)一定温度下,在容积为1L的密闭容器中进行反应:aN(g)
 bM(g) △H<0,M、N的物质的量随时间的变化曲线如图所示:
bM(g) △H<0,M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中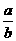 =
.
=
.
(2)从t1到t2时刻,以M的浓度变化表示的平均反应速率为 。t2时两线的交叉点 (填“是”或“不是”)平衡状态,此时v正 (填“>”、“<”或“=”)v逆.
(3)下列描述中能说明上述反应达到平衡状态的是 (填字母)
A. 容器中M与N的物质的量之比为1:1 B. 混合气体的密度不随时间的变化而变化
C. 混合气体的总物质的量不随时间的变化而变化
D. 单位时间内消耗a molN的同时生成bmol M E. 混合气体的压强不随时间的变化而变化
20、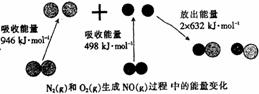 (10分)Ⅰ.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化:
(10分)Ⅰ.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化:
人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N键的键能为 kJ·mol-1. 根据上图写出NO(g)分解生成N2(g)和O2(g)的化学方程式为 ;当有16g O2(g)生成时,该反应中放出的热量为 kJ.
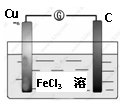 Ⅱ.如图所示的原电池中:
Ⅱ.如图所示的原电池中:
①负极材料是 ,
电极反应式是
②正极材料是 ,
电极反应式是 .
19、(8分)已知X、Y、Z、W是四种短周期元素,且原子序数依次增大。X、W同主族,W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。常温下,Y与Z组成的化合物是红棕色气体。请回答下列问题:
(1)写出X、Z两种元素的元素符号:X ,Z 。
(2)由以上四种元素两两形成的化合物中:
①溶于水显碱性的气态氢化物的电子式为 ,它所含的共价键属于 (填“极性”或“非极性”)键。
②含有极性共价键和非极性共价键并且具有漂白性的化合物的电子式为 .
(3)由X、Y、Z三种元素形成的常见离子化合物是 (填化学式);X与W形成的离子化合物的电子式为 .
(4)用电子式表示W与Z形成化合物W2Z的过程: .
18、(10分)近年来,国际原油价格大幅上涨,促使各国政府加大生物能源生产,其中乙醇汽油已进入实用化阶段。
(1)柴油是含C15-C18的碳氢化合物的混合物,这些碳氢化合物属于有机物中的________类。
(2)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X的结构简式是__________。
(3) 乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是_________。在浓硫酸作用下,乙醇与Y反应可生成一种有香味的物质W,化学方程式为______________。
(4)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是_______或________。
(5)工业上通过乙烯与水在一定条件下反应制得乙醇,反应类型是__________;现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷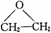 ,该反应的原子利用率为100%,反应的化学方程式为________________________。
,该反应的原子利用率为100%,反应的化学方程式为________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com