
题目列表(包括答案和解析)
28.根据烷、烯、炔烃燃烧的反应方程式,有人总结出以下规律:对于烷烃有n(烷烃)=n(H2O)-n(CO2),对于烯烃有n(H2O)-n(CO2)=0,对于炔烃有n(炔烃)=n(CO2)-n(H2O)。请回答下列问题:
(1)某混合气体由C2H6和C3H4组成。将1.0L混合气在氧气中充分燃烧,产生的CO2体积比水蒸气多0.2L(相同状况下测定),通过计算确定C2H6的体积。(请写出计算过程)
(2)某混合气由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0L混合气在氧气中充分燃烧,产生3.0LCO2和2.4L水蒸气(相同状况下测定)。试判断混合气是由烯烃和 ▲ 两类烃组成,其体积比为___▲_____。
27.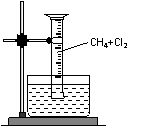 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。
请填写下列空白:
[实验一]用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。
(1)该反应的化学方程式为 ▲ ;(只写第一步)
(2)水槽中盛放的液体最好为 ▲ ;(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
[实验二]用排蒸馏水法收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(3)该实验设计的错误之处 ▲ ;
[实验三]
步骤一:收集半试管氯气,加入10 mL 蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL 蒸馏水,充分振荡,测得pH = 1.00。
(4)判断该反应中有氯化氢生成的依据是 ▲ ;
(5)假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00 mL,取20.00 mL稀释液,加入10.00 mL浓度为0.01 mol·L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为 ▲ mL;
26. 熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e-=34CO2+10H2O。试回答下列问题:
熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e-=34CO2+10H2O。试回答下列问题:
(1)该燃料电池的化学反应方程式为 ▲ 。
(2)正极电极反应式为 ▲ 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ▲ 。
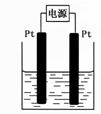
(4)某学生想用该燃料电池和右图所示装置来电解饱和食盐水。
①写出该反应的离子方程式 ▲ 。
②若电解后得到200mL3.25mol/LNaOH溶液,则消耗C4H10 的体积在标准状况下为 ▲ mL。
25.烯烃A在一定条件下可以按下图所示进行反应:
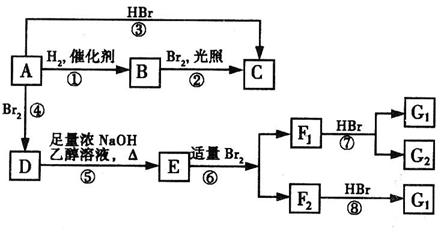
(D是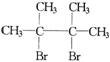 ,
,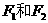 互为同分异构体,
互为同分异构体,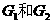 互为同分异构体。)
互为同分异构体。)
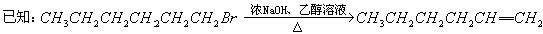
请回答下列问题:
(1)A的结构简式是 ▲ ;G1的结构简式是 ▲ 。高*考*资*源*网
(2)用系统命名法命名有机物B,B的名称是 ▲ 。
(3)框图中属于取代反应的是 ▲ 。(填数字代号)
(4)E→F2的化学反应方程式 ▲ ,属于 ▲ 反应。
24.现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。已知:
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化:
 G
P
Q
M+P ;
G
P
Q
M+P ;
④E和D是同主族元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
请回答下列问题:
(1)B元素的名称是 ▲ ;(2)E元素的原子结构示意图是 ▲ 。
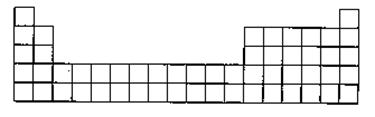
(3)请将C的元素符号填在如图所示的元素周期表的适当位置上。
(4)G的电子式为 ▲ 。
(5)化合物X所含化学键类型有 ▲ 。
(6)①A的氧化物与NaOH溶液反应的离子方程式为 ▲ 。
②M的稀溶液与铜反应的化学方程式为 ▲ 。
23.烷基取代苯( )可以被酸性KMnO4溶液氧化生成
)可以被酸性KMnO4溶液氧化生成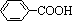 ,但若烷基R中直接与苯环连接的碳原子没有C-H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子没有C-H键,则不容易被氧化得到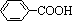 。现有分子式是C11H16的烷基一取代苯,则它可以被氧化成为
。现有分子式是C11H16的烷基一取代苯,则它可以被氧化成为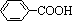 的同分异构体共有 ▲ 种,并写出一种不能被氧化成为
的同分异构体共有 ▲ 种,并写出一种不能被氧化成为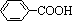 的同分异构体的结构简式 ▲ 。
的同分异构体的结构简式 ▲ 。
22.已知,在常温常压条件下,氢气的热值为143kJ/g,请写出该条件下H2燃烧的热化学方程式 ▲ 。
21.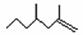 已知有机物CH3CH=C(CH3)CH3,可表示为
已知有机物CH3CH=C(CH3)CH3,可表示为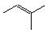 。经研究发现,家蚕的信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3,白蚁的信息素有:
(甲) , (乙)。下列说法正确的是( )
。经研究发现,家蚕的信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3,白蚁的信息素有:
(甲) , (乙)。下列说法正确的是( )
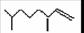 A.家蚕信息素与1molBr2加成产物只有两种
A.家蚕信息素与1molBr2加成产物只有两种
B.家蚕信息素是乙烯的同系物
C.白蚁信息素甲与乙互为同分异构体
D.白蚁信息素乙的名称为3,7-二甲基-1-辛烯
第Ⅱ卷(非选择题 共52分)
20.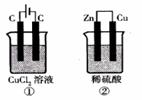 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
A.产生气体的体积:①>②
B.溶液的pH变化:①增大 ②不变
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极 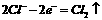 ②中负极
②中负极 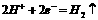
19.下面有关丙烷、丙烯、丙炔说法中正确的有( )
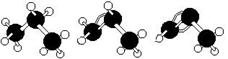 A.丙烷、丙烯、丙炔的结构简式分别为
A.丙烷、丙烯、丙炔的结构简式分别为
B.相同物质的量的三种物质完全燃烧后,在标准状况下,生成的气体体积比7:6:5
C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高
D.丙烷、丙烯、丙炔三种物质分子中所有的碳原子都处在同一平面
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com