
题目列表(包括答案和解析)
28.已知Zn(s)+1/2O2(g)===ZnO(s);ΔH=-350 kJ/mol,则1 g Zn在氧气中燃烧放出的热量约为: A.5.4 kJ B.350 kJ C.3.5kJ D.8.5kJ
27.燃料电池是一种新型电池,它主要是利用燃料在燃烧过程中把化学能直接转化为电能.氢氧燃料电池的基本反应是:X极:1/2 O2(g)+H2O(l)+2e-=2OH-
Y极:H2(g)+2OH-=2H2O(l)+2e-下列判断正确的是
A.X是正极 B.Y是正极 C.Y极发生还原反应 D.Y极发生氧化反应
26.可逆反应: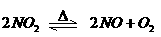 在密闭容器反应,达到平衡状态的标志是
在密闭容器反应,达到平衡状态的标志是
①单位时间内生成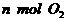 的同时生成
的同时生成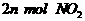
②单位时间内生成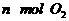 的同时,生成
的同时,生成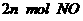
③用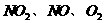 的物质的量浓度变化表示反应速率的比为2:2:1的状态
的物质的量浓度变化表示反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①④⑤ B.②③⑤ C.①③④ D.①②③④⑤
25.将盐酸滴到碳酸钠粉末上,能使反应的最初速率加快的是
A. 盐酸浓度不变,使用量增大1倍 B. 盐酸浓度增加1倍,用量减至1/2
C. 增大碳酸钠粉末的用量 D. 使反应在较高温度下进行
24.(2004江苏)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) ,下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
23.(2004天津)下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A. a电极是负极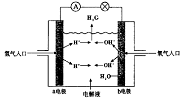
B. b电极的电极反应为:4OH--4e-=2H2O +O2↑
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
21.(1996年)已知 4NH3(气)+5O2(气)= 4NO(气)+6H2O(气),若反应速率分别是V(NH3)、V(O2)、V(NO)、V(H2O)[mol/(L·min)]表示,则正确的关系是
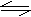 A.4/5V(NH3)=V(O2) B.5/6V(O2)=V(H2O) C.3/2V(NH3)=V(H2O) D.4/5V(O2)=V(NO) 22.可逆反应
A.4/5V(NH3)=V(O2) B.5/6V(O2)=V(H2O) C.3/2V(NH3)=V(H2O) D.4/5V(O2)=V(NO) 22.可逆反应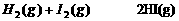 达到平衡时的标志是
达到平衡时的标志是
A.混合气体密度恒定不变 B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等 D.I2在混合气体中体积分数不变
20.过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.升高温度 B.加入适量的水
C.加入少量CuSO4溶液 D.加入浓度较大的盐酸
19.决定化学反应速率的主要因素是
A.参加反应的物质本身的性质 B.催化剂
C.温度、压强以及反应物的接触面 D.反应物的浓度
18.下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸的反应 B.灼热的木炭与COz反应
C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com