
题目列表(包括答案和解析)
2、放射性同位素钬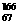 Ho的原子核内的中子数与核外电子数之差是
Ho的原子核内的中子数与核外电子数之差是
A.32 B.67 C.99 D.166
1、根据元素周期表,判断下列元素中不属于主族元素的是
A.磷 B.钙 C.铁 D.碘
19.⑴BaCl2、BaSO4、AgCl⑵除去过量的BaCl2和AgNO3⑶Na2CO3、HCl、蒸发
18. ( 8 )将配好的稀硫酸倒入试剂瓶中,贴好标签;
( 7 )盖好容量瓶塞,反复颠倒摇匀;
( 1 )用量筒量取11.1ml的18.0 mol·L-1的浓硫酸;
( 2 )将浓硫酸沿烧杯内壁慢慢注入盛有少量蒸馏水的烧杯中;
( 4 )用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
( 3 )将已冷却至室温的硫酸溶液沿玻璃棒注入100mL容量瓶;
( 6 )改用胶头滴管逐滴加蒸馏水,至凹液面与刻度线相切;
( 5 )继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处
小于、小于
17.⑴防止暴沸;⑵冷凝水蒸气;⑶冰水混合物。
19. (14分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂出去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
(14分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂出去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示: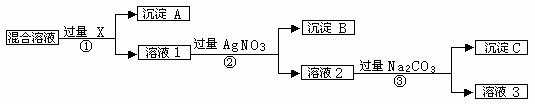
请回答下列问题:
⑴写出实验流程中下列物质的化学式: 试剂X_________,沉淀A________,沉淀B___________。
⑵上述实验流程中加入过量的Na2CO3的目的是____________________________
______________________________________________________。
⑶按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
www.k@s@5@ 高#考#资#源#网 答案
18.(16分)把18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100 ml,实验操作如下,请把正确操作步骤(用1,2,3……表示)的序号填入括号内,并填写有关的空格:
( )将配好的稀硫酸倒入试剂瓶中,贴好标签; www.k@s@5@ 高#考#资#源#网
( )盖好容量瓶塞,反复颠倒摇匀;
( )用量筒量取 ml的18.0 mol·L-1的浓硫酸;
( )将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
( )用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
( )将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
( )改用胶头滴管逐滴加蒸馏水,至____________________________;
( )继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;
请回答:
若在操作中没有把少量蒸馏水洗涤烧杯的洗涤液全部转移到容量瓶中,会使稀硫酸溶液的浓度 (填“大于”、“小于”或“等于”)2.00 mol·L-1.若加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水到刻度线,会使稀硫酸溶液的浓度 (填“大于”、“小于”或“等于”)2.00 mol·L-1。
17.(6分)右图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
⑴左边大试管中要加入几片碎瓷片,其作用是 ;
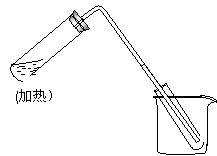 ⑵该装置中使用的玻璃导管较长,其作用是
;
⑵该装置中使用的玻璃导管较长,其作用是
;
⑶烧杯中还要盛有的物质是 。
16.相同质量的H2SO4与H3PO4中的氢原子数之比为 ( )
A.2: 3 B.3: 2 C.1:2 D.2:1
班级______________姓名____________学号____________得分_____________
15.下列溶液中,与100 ml 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是 ( )
A.100 ml 0.5 mol/L MgCl2 溶液 B.200 ml 0.25 mol/L HCl溶液
C.50 ml 1 mol/L NaCl溶液 D.200 ml 0.25 mol/L CaCl2溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com