
题目列表(包括答案和解析)
22.(8分)为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
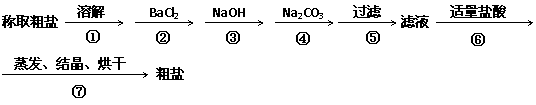
 ⑴判断BaCl2已过量的方法是
⑴判断BaCl2已过量的方法是
。
⑵第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要
存在形式为CaCl2) 。
⑶若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
。
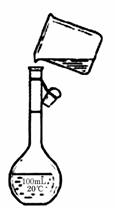
⑷为检验精盐纯度,需配制250 mL 0.2 mol/L NaCl(精盐)溶液,
题图是该同学转移溶液的示意图,图中的错误是
21.(14分)欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①量筒 ②烧杯 ③玻璃棒 ④____________, ⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线 D.洗净所用仪器
E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度偏____________。
④在转入容量瓶前烧杯中液体应____________,否则会使浓度偏____________;并洗涤烧杯和玻璃棒2-3次,洗涤液也要转入容量瓶,否则会使浓度____________。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度____________。
20.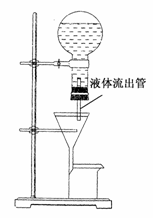 (6分)某学生为了使过滤操作能自动添加液体,设计了
(6分)某学生为了使过滤操作能自动添加液体,设计了
“自动加液过滤器”如图所示。在倒置的烧瓶中盛放待
过滤的液体,液体从“液体流出管”流入漏斗,为使液体
顺利流下,还需插入“空气导入管”与大气相通。
(1)“空气导入管”下口应在______________,
上口应在______________。
A.滤纸边沿下方 B.滤纸边沿上方
C.待过滤液液面上方 D.待过滤液中
E.A和B项均可 F.C和D项均可
(2)试简要说明自动加液过滤的原理:________________
19. (9分)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为________。设溶液的密度为ρg/cm3,则该溶液的物质的量浓度为__________mol·L-1。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________mol·L-1。
18. 有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/
mol·L-1为
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/
mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
17.下列物质中所含分子物质的量最多的是
A.4℃时2.7mL 水 B.2.24L一氧化碳(标准状况下)
C.6.02×1022个氯化氢分子 D.4.9g 磷酸
16.同温同压下,等质量的下列气体所占有的体积最大的是
A.O3 B.CH4 C.CO D.N2
15.下列叙述正确的是
A.1 mol H2O的质量为18g/mol B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4L
14.下列关于粗盐提纯说法正确的是
A.溶解粗盐时,应尽量使溶液稀些,以保证食盐完全溶解
B.滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干
D.将制得的晶体转移到新制过滤器中用大量水进行洗涤
13.下列说法中正确的是( )
A.标准状况下,22.4L水中所含的分子数约为6.02×1023
B.标准状况下,aL的氧气和氮气的混合物含有的分子数约为×6.02×1023
C.常温常压下,48g O3气体含有的氧原子数为6.02×1023
D.2.24L CO2中含有的原子数为0.3×6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com