
题目列表(包括答案和解析)
2. 锂电池是新型高能电池,它以质轻、容量大而受到重视。目前已经制成多种功能的锂电池。某种锂电池的总反应可表示为:Li+MnO2 LiMnO2。若该电池提供0.5C电量,则消耗正极材料的质量约为(其他损耗忽略不计) ( )
锂电池是新型高能电池,它以质轻、容量大而受到重视。目前已经制成多种功能的锂电池。某种锂电池的总反应可表示为:Li+MnO2 LiMnO2。若该电池提供0.5C电量,则消耗正极材料的质量约为(其他损耗忽略不计) ( )
A.3.5g B.7g C.4.52×10-4g D.43.5g
1.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电
极,其电极反应式为:H2+2OH--2e-=2H2O和1/2O2+H2O+2e-=2OH-,则下列叙述正确的是
( )
A.通H2的一极是正极,通O2的一极是负极
B.通O2的一极是正极,通H2的一极是负极
C.工作一段时间后电解质溶液pH增大
D.工作时负极区附近pH减小
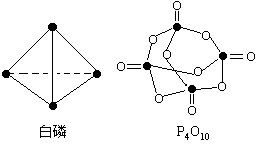
12.白磷(P4)是正四面体构型的分子,当与氧气作用形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子。
(1)化学反应可视为旧键断裂和新键形成的过程。现提供以下化学键的键能(kJ·mol-1)。P-P键:198 kJ·mol-1;P-O键:360 kJ·mol-1;O=O键:498 kJ· mol-1;P=O键:585 kJ· mol-1。
试根据这些数据,计算出以下反应的反应热:P4(白磷)+5O2=P4O10。
(2)P4O10极易与水化合,反应过程可表示为 如下形式:P-O-P+H2O→2P-OH。若每个P4O10分子与四个水分子发生化合反应,写出该反应的化学方程式。
11.已知H-H键能为436 KJ/mol,H-N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3 ΔH=-92.4 KJ/mol,则N≡N键的键能是多少?
10.已知下列两个热化学方程式;
H2(g)+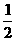 O2(g)===H2O(1); △H=-285.6kJ/mol
O2(g)===H2O(1); △H=-285.6kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol写出丙烷燃烧生成CO2和气态水的热化学方程式。
9.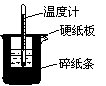 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置看,图中尚缺少的一种玻璃用品是_______________。
(2)烧杯间填满碎纸条的作用是_________________________。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量__________(填“相等”或“不相等”),中和热__________(填“相等”或“不相等”),理由是__________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会____________。(填“偏大”、“偏小”或“无影响”)。
(5)完整地做一次这样的实验,需测定______次温度。
(6)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”
8.已知H2(g)+1/2O2(g)=H2O(l) ;△H= ─285.8KJ/moL可通过两种途径来完成
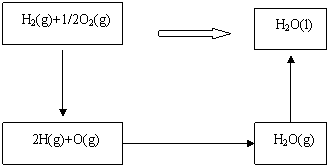
分步进行的热效应如下:
(1)H2(g)=2H(g) △H1= +431.8KJ/moL
(2)1/2O2(g)=O(g) △H2= +244.3KJ/moL
(3)2H(g)+O(g)=H2O(g) △H3=
(4)H2O(g)→H2O(L) △H= -44KJ/moL
7.已知C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(g);△H1;
H2O(g)==H2O(1);△H2;C2H5OH(g)==C2H5OH(1);△H3
若使23 g C2H5OH(1)完全燃烧生成H2O(1),则放出的热量为
6.强酸和强碱在稀溶液中的中和热可表示为
H+(aq)+OH-(aq)=H2O(l); △H= -57.3k kJ·mol-1,又知在溶液中反应有: CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l); △H=-Q1kJ·mol-1, H2SO4(浓)+NaOH(aq)=Na2SO4(aq)+H2O(l) ; △H= -Q2 kJ·mol-1
HNO3(aq)+KOH(aq) KNO3(aq)+H2O(l) ; △H= -Q3 kJ·mol-1,则Q1、Q2、Q3的关系正确的是 ( )
KNO3(aq)+H2O(l) ; △H= -Q3 kJ·mol-1,则Q1、Q2、Q3的关系正确的是 ( )
A.Q1 = Q2 = Q3 B.Q2 > Q1 > Q3 C.Q2 > Q3 > Q1 D.Q2 = Q3 > Q1
5.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是 ( )
A.CH3OH(l)+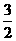 O2(g)
O2(g) CO2(g)+2H2O(l) △H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=+1452 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com