
题目列表(包括答案和解析)
9.把0.6molX气体和0.4molY气体混合2L于容器中使它们发生如下反应,3X(气)+Y(气) 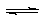 nZ(气)+2W(气),5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min,则
nZ(气)+2W(气),5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min,则
(1)上述反应中Z气体的反应方程式系数n的值是 ( )
A.1 B.2 C.3 D.4
(2)上述反应在5分钟末时,已消耗的Y值占原来的分数是 ( ) A.20% B.25% C.33% D.50%
8.在2A+B==3C+4D反应中,下面表示的反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·s-1 B. v (B)=0.005 mol·L-1·s-1
C.v (C)=0.9 mol·L-1·s-1 D.v (D)=1.0 mol·L-1·s-1
7.某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过tmin后,测得物质的浓度分别为c(X)=0.4mol/L,c(Y)=0.8mol/L,c(Z)=0.4mol/L,则反应式可表示为 ( )
A.X2+2Y2==2XY2 B.2X2+Y2==2X2Y
C.3X2+2Y2==2X3Y D.X2+3Y2==2XY3
6.某温度下,反应2N2O5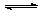 4NO2+O2开始进行时c(N2O5)=0.048
mol.L-1,过1 min后c(N2O5)=0.03 mol.L-1,则该反应的反应速率为
( )
4NO2+O2开始进行时c(N2O5)=0.048
mol.L-1,过1 min后c(N2O5)=0.03 mol.L-1,则该反应的反应速率为
( )
A.v(N2O5)=1.8×10-4mol·L-1·s-1 B.v(O2)=1.8×10-4mol·L-1·s-1
C.v(N2O5)=1.08×10-2mol·L-1·s-1 D.v(NO2)=2v(N2O5)
5.已知:4NH3+5O2==4NO+6H2O,若反应的速率分别用v (NH3)、v (NO)、v (H2O) (mol·L-1·s-1)来表示,则正确的关系是 ( )
A.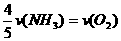 B.
B.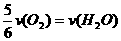
C.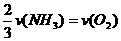 D.
D.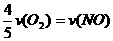
4.反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速率v=k(CH2)m(CCl2)n,式中k为常数,m、n值可用下表中数据确定。由此可推得的m、n值正确的是 ( )
|
CH2 (mol·L-1) |
CCl2 (mol·L-1) |
v(mol·L-1·s-1) |
|
1.0 |
1.0 |
1.0k |
|
2.0 |
1.0 |
2.0k |
|
2.0 |
4.0 |
4.0k |
A.m=1,n=1 B.m=1/2,n=1/2
C.m=1/2,n=1 D.m=1,n=1/2
3.在N2+3H2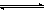 2NH3的反应中,经过一段时间内,NH3的浓度增加了0.6 mol·L-1,在此段时间内用H2表示的平均反应速率为0.45 mol·L-1·s-1,则所经过的时间是 ( )
2NH3的反应中,经过一段时间内,NH3的浓度增加了0.6 mol·L-1,在此段时间内用H2表示的平均反应速率为0.45 mol·L-1·s-1,则所经过的时间是 ( )
A.1 s B.2 s C.0.44 s D.1.33 s
2. 已知反应A+3B====2C+D在某段时间内以A的浓度变化表示的化学反应速率为
1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为 ( )
A.0.5 mol·L-1·min-1? B.1 mol·L-1·min-1
C.2 mol·L-1·min-1 D.3 mol·L-1·min-1
1.某一反应物的浓度是 2.0 mol·L-1,经过4 min后,它的浓度变成1.68 mol·L-1,则在这4 min内它的平均反应速率为 ( )
A. 0.2 mol·L-1·min-1 B. 0.1 mol·L-1·min-1
C. 0.04 mol·L-1·min-1 D. 0.08 mol·L-1·min-1
14.熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物做电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
 阳极反应式:2CO+2CO32- 4CO2+4e-
阳极反应式:2CO+2CO32- 4CO2+4e-
阴极反应式:
总电池反应:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com