
题目列表(包括答案和解析)
1.对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知:B
A.化学反应速率变化时,化学平衡一定发生移动。
B.化学平衡发生移动时,化学反应速率一定变化。
C.正反应进行的程度大.正反应速率一定大。
D.只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况。
16. (11分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率()与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率()与体系总压强(p)的关系如图所示。根据图示回答下列问题:
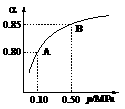
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于____________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);DH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为_____________(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
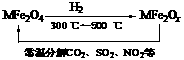
请写出MFe2Ox分解SO2的化学方程式______________________________________(不必配平)。
(1)①800 L·mol-1。② =。 (2)1.60NA(或1.6NA);173.4。 (3)MFe2Ox+SO2 MFe2O4+S。
MFe2O4+S。
15. (14分)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气)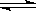 C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
(1)(1-a) (2)3a (3)2 3-3a 丁
若3a>1,B的物质的量小于2mol;若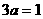 ,B的物质的量等于2mol;
,B的物质的量等于2mol;
若3a<1,B的物质的量大于2mol
(4)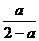
(5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a
14.(12分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B和C均为4.0摩、D为6.5摩、F为2.0摩,设E为x摩.当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.请填写以下空白:


(1)若x=4.5,则右侧反应在起始时向 (填"正反应"或"逆反应")方向进行.欲使起始反应维持向该方向进行,则x的最大取值应小于 .
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等? (填"相等"、"不相等"或"不能确定").其理由是:
(1)正反应 (1分) 7.0(2分)
 提示:设达平衡时E的消耗量为2a摩.
提示:设达平衡时E的消耗量为2a摩.
起始时:6.5 x 2.0
平衡时:6.5-a x-2a 2.0+2a
因左侧反应混和物总的物质的量为12摩,所以达平衡时,右侧反应需满足:
13. (15分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=-196.6kJ/mol.
2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
(15分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=-196.6kJ/mol.
2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同) 。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是 。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO)2:n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为 。
(1)0.1mol/L·min(3分) 20%(3分)
(2)ABE (3分)
(3)AD(3分)
(4)80%(3分)
12、难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
|
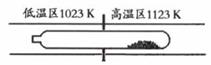
|
 Tal4
(g)+S2 (g)
Tal4
(g)+S2 (g)
下列说法正确的是
A.在不同温度区域,Tal4 的量保持不变
B.在提纯过程中,l2 的量不断减少
C.在提纯过程中,l1 的作用是将TaS2 从高温区转移到低温区
D.该反应的平衡常数与Tal4 和S2 的浓度乘积成反比
答题表
11、在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
 B.反应可表示为X+3Y 2Z,其平衡常数为1600
B.反应可表示为X+3Y 2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
10. 某探究小组利用丙酮的溴代反应(CH3COCH3+Br2→CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2→CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率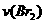 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
|
实验序号 |
初始浓度c/mol·L-1 |
溴颜色消失所需时间t/s |
|
|
① ② ③ ④ |
CH3COCH3 |
HC1 |
Br3 |
|
0.80 1.60 0.80 0.80 |
0.20 0.20 0.40 0.20 |
0.0010 0.0010 0.0010 0.0020 |
290 145 145 580 |
分析实验数据所得出的结论不正确的是
 A.增大
A.增大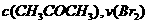 增大 B.实验②和③的
增大 B.实验②和③的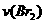 相等
相等
 C.增大
C.增大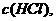
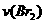 增大 D.增大
增大 D.增大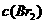 ,
,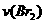 增大
增大
9. 向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g) CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,超始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,超始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
(A)0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
(B)1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
(C)0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
(D)0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
8. 工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);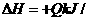 mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L min)
min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com