
题目列表(包括答案和解析)
7.α1和α2分别为A、B在两个恒容容器中平衡体系A(g) 2B(g)和2A(g)
2B(g)和2A(g) B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.α1、α2均减小 B.α1、α2均增大
C.α1减小,α2增大 D.α1增大,α2减小
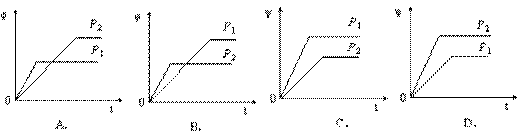
6.在一定温度不同压强(P1<P2)下,可逆反应2X(g)  2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
5.一定条件下反应2AB(g) 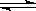 A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
4.在2升的密闭容器中,发生以下反应:2A(g)+ B(g) 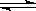 2C(g)+D(g)
。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)
。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
3.过程的自发性的作用是
A.判断过程的方向 B.确定过程是否一定会发生
C.判断过程发生的速率 D.判断过程的热效应
2.下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
1.在2A+B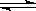 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
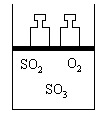
24.如右图所示将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
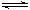 2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2 mol。若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,回答下列问题:
2SO3(g);ΔH<0。该反应达到平衡状态A时,测得气体总物质的量为4.2 mol。若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,回答下列问题:
 ⑴ 在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数__
⑴ 在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数__
减小__(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变
到与平衡状态A相同,可采取的措施有: 升温 或 减压 。
⑵ 若起始时a=1.2mol,b=0.6mol,且达到平衡后各气体的体积分数与
平衡状态A相同,则起始时c的取值为 任意值 。
⑶ 若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态A相同,则起始时c的取值范围是 3.6<c≤4 。
23.(8分)将1mol CO和1mol H2O(g)充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g) CO2+H2,此时有
CO2+H2,此时有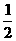 的CO转化为CO2。
的CO转化为CO2。
(1)该平衡混合物中CO2的物质的量分数为 。
(2)温度不变的条件下向该平衡体系中再充入一定量的氩气,CO的转化率
(填“增大”、“减小”、“不变”)
(3)温度不变的条件下向该平衡体系中再充入1mol CO2和1mol H2,则达新平衡时CO2的物质的量分数为 。
(4)若在相同条件下,开始时向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是下列各值中的 (填编号)
A.16.67% B.27.55% C.33.3% D.36.8%
答案:(1)25%(2分) (2)不变(2分) (3)25%(2分) (4)B(2分)
22.有可逆反应A+B 2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图2-4-1所示,那么:
2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图2-4-1所示,那么:
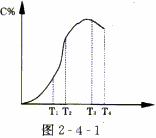
(1)反应在___________________温度下达到化学平衡;
(2)此反应在正反应为______________________热反应;
(3)由T1向T2变化时,V正______________________V逆(填>、<、=);
(4)由T3向T4变化时,V正______________________V逆(填>、<、=).V正
答案:本题考查的是温度与反应热效应及化学反应速率、化学平衡的关系问题.如图可看出温度对化学反应中C%的影响是变化的:反应刚开始时温度越高,C%越大;反应的后期温度越高,C%越小.那么考虑温度对化学平衡的影响应该看哪一段呢?图上C%由零开始,说明原来加入的物质只有A和B,反应刚开始时完全为正向进行,生成C物质,C%只能增多.而在反应后期体系中已经存在C物质,才能体现出温度对C%的影响,所以应该看后段.温度越高,C%越小,说明反应逆向进行,所以正反应为放热反应.在T1向T2变化时,C%变大,说明反应正方向进行,所以V正>V逆;由T3向T4变化时,C%变小,说明反应逆方向进行,所以V正<V逆.T3温度时为转折点,说明这一点V正=V逆,为化学平衡点. 答案 (1)T3;(2)放;(3)>;(4)<
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com