
题目列表(包括答案和解析)
4. 乙酸蒸气能形成二聚分子: 2CH3COOH(气) (CH3COOH)2(气);⊿H<0。现欲测定乙酸的相对分子质量,应采用的反应条件是:
( )
乙酸蒸气能形成二聚分子: 2CH3COOH(气) (CH3COOH)2(气);⊿H<0。现欲测定乙酸的相对分子质量,应采用的反应条件是:
( )
A.低温高压 B.高温低压 C.低温低压 D.高温高压
1.4NH3(g)+5O2(g)== 4NO(g)+6H2O(g),该反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的平均速率为 ( ) A. V(O2)=0.01mol•L-1•s-1 B.V(NO)=0.008 mol•L-1•s-1 C.V(H2O)=0.003 mol•L-1•s-1 D.V(NH3) =0.003 mol•L-1•s-1 2. 把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应: 3X(g)+Y(g)== n Z(g)+2W(g); 5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01 mol•L-1•min-1,则上述反应中Z气体的反应方程式系数n的值是 ( ) A.1 B.2 C.3 D.4 3.一定温度下,在2L的密闭容器中,X 、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
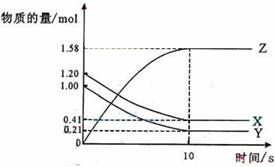
下列描述正确的是: ( )
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)
 Z(g)
Z(g)
26.(9分)某温度下SO2的转化反应的平衡常数K =532.4.
2SO2+O2
 2SO3
2SO3
下面三个混合体系中各物质的浓度如下表:
|
体系 |
c(SO2) mol/L |
c(O2) mol/L |
c(SO3) mol/L |
反应方向 |
|
(1) |
0.0600 |
0.400 |
2.000 |
|
|
(2) |
0.0960 |
0.300 |
0.500 |
|
|
(3) |
0.0862 |
0.263 |
1.020 |
|
试判断各体系中反应进行的方向:
体系(1)
体系(2)
体系(3) 。
25.(9分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
24.(12分)将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应:
I2(g)
+ H2(g)  2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
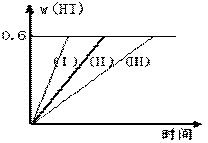
(1)达平衡时,I2(g)的物质的量浓度为 。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是 ,则乙条件可能是 。
(填入下列条件的序号)
①恒容条件下,升高温度;
②恒容条件下,降低温度;
③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;
⑤恒温恒容条件下,加入适当催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系是 。
23.(6分)⑴反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是
______ _________。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
22.(16分)
(1)(6分)对于下列反应:2SO2 + O2  2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ ______。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ ______。
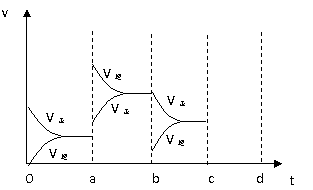 (2)(6分)下图左表示在密闭容器中反应:2SO2+O2
(2)(6分)下图左表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;
若增大压强时,反应速度变化情况画在c~d处.
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;
若增大压强时,反应速度变化情况画在c~d处.
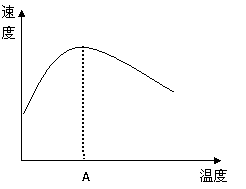 (3)(4分)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。
(3)(4分)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。
解释曲线变化原因
。
21.(8分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
3.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol/L硫酸 |
均无明显现象(无气泡产生) |
||||
|
3.0mol/L硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式______________________________________________
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是_______________________
_____________________________________________________________________________。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪
些假设或猜想(列出两种即可)?
假设一:________________________________________________________________________
假设二:________________________________________________________________________
20. 某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) 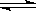 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大
B. 平衡不发生移动
C. 平衡向逆反应方向移动
D. 物质C的质量分数增大
19.反应PCl5(g) PCl 3(g)+Cl2(g) ①
PCl 3(g)+Cl2(g) ①
2HI(g) H2(g)+I2(g)
②
H2(g)+I2(g)
②
2NO2(g) N2O4(g)
③
N2O4(g)
③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率
A.均不变 B.均增大
C.①增大,②不变,③减少 D.①减少,②不变,③增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com