
题目列表(包括答案和解析)
12.磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热 ΔH= 。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式: 。
11.已知下列两个热化学方程式;
H2(g)+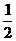 O2(g)===H2O(1); △H=-285.6kJ/mol
O2(g)===H2O(1); △H=-285.6kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol写出丙烷燃烧生成CO2和气态水的热化学方程式。
10.有些盐的结晶水合物,白天在温度不太高时就能熔化(实质是溶于自身的结晶水中),同时吸收热量;在晚上又可缓慢凝固而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
|
|
Na2S2O3·5H2O |
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
熔点(℃) |
40.50 |
29.92 |
32.38 |
35.1 |
|
熔化热(kJ/mol) |
49.7 |
37.3 |
77 |
100.1 |
(1)上述四种水合晶体盐中最适宜用做潜热材料的两种盐是(用化学式表示)
; 。
(2)实际应用时最常采用的(由来源和成本考虑)应该是
。
9.已知:C(s)+O2(g) = CO2(g);△H=-393.5 kJ/mol
H2(g)+ 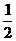 O2 (g)=H2O(g);△H=-241.5
kJ/mol
O2 (g)=H2O(g);△H=-241.5
kJ/mol
欲得相同热量,需充分燃烧 C和 H2的质量比约为 ( )
A.12:3.25 B.3.25:12 C.1:1 D.6:1
8.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g) + 1/2O2(g) = H2O(l);△H= -285.8 kJ/mol
CO(g) + 1/2O2(g) = CO2(g);△H= -283.0 kJ/mol
C8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l);△H= -5518 kJ/mol
CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l);△H= -890.3 kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是 ( )
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是 ( )
A.C(s)+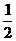 O2(g)=CO(g);△H=-393.5 kJ/mol
O2(g)=CO(g);△H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.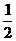 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1 400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1 400 kJ/mol
7. 25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、
6.关于用水制取二级能源氢气,以下研究方向不正确的是 ( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚集,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
5.已知热化学方程式:SO2(g)+ O2(g) 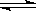 SO3(g) △H
= ―98.32kJ/mol,在容器中充
SO3(g) △H
= ―98.32kJ/mol,在容器中充
入2molSO2和1molO2充分反应,最终放出的热量为 ( )
A. 196.64kJ B. 196.64kJ/mol
C. <196.64kJ D. >196.64kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com