
题目列表(包括答案和解析)
5.写出难溶电解质PbCl2、AgBr、Ba3(PO4)2、Ag2S的溶解平衡表达式或溶度积表达式错误的是 ( )
A.PbCl2(s)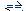 Pb2++2Cl-; Ksp==c(Pb2+)·c(Cl-)2
Pb2++2Cl-; Ksp==c(Pb2+)·c(Cl-)2
B.AgBr(s)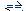 Ag++Br-; Ksp==c(Ag+)·c(Br-)
Ag++Br-; Ksp==c(Ag+)·c(Br-)
C.Ba3(PO4)2(s)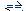 3Ba2++2PO43-;Ksp==c(Ba2+)3·c(PO43-)2
3Ba2++2PO43-;Ksp==c(Ba2+)3·c(PO43-)2
D.Ag2S(s)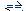 2Ag++S2-;Ksp==c(Ag+)·c(S2-)
2Ag++S2-;Ksp==c(Ag+)·c(S2-)
4.已知常温下BaSO4的溶解度为2.33×10-4g,类似于水的离子积,难溶盐AmBn也有离子积Ksp且Ksp=(C(An+))m·(C(Bm-))n,,则其Ksp为 ( )
A.2.33×10-4 B.1×10-5 C.1×10-10 D.1×10-12
3.有关AgCl沉淀的溶解平衡说法正确的是 ( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
2.一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其它电离的离子间的溶解平衡关系:Ba(OH)2(固体) 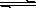 Ba2++2OH-。向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
( )
Ba2++2OH-。向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
( )
A.溶液中钡离子数目减小 B.溶液中钡离子浓度减少
C.溶液中氢氧根离子浓度增大 D.PH减小
1.试验室中,要使AlCl3溶液中的全部沉淀出来,最适宜选用的试剂是 ( )
A. Ba(OH)2溶液 B . NaOH溶液 C. 盐酸 D. 氨水
24、(6分)已知MnO2与浓盐酸可以发生如下反应:
4HCl(浓)+MnO2
 MnCl2
+Cl2↑ +2H2O,若产生标准状况下2.24L氯气,求:
MnCl2
+Cl2↑ +2H2O,若产生标准状况下2.24L氯气,求:
(1)反应过程中转移电子的物质的量为多少?
(2)参加反应的MnO2质量是多少?
江苏省泰州中学2010-2011学年度第一学期
23、(11分)实验室需配制250 mL 0.1 mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制250 mL 0.1 mol/L的Na2CO3溶液
|
实际应称Na2CO3质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
|
|
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_____________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.用托盘天平准确称取所需的Na2CO3固体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作______________;若加蒸馏水时不慎超过了刻度_____________;若定容时俯视刻度线_______________。
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度______________;向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面_______________。
22、(8分)现有A、B、C、D四种化合物的焰色反应均呈黄色。A、B、C分别和足量的盐酸反应后,均可生成D。若将固体C加热后可生成A和无色无味的气体E,若在A溶液中通入足量E,可生成C;若B与C的溶液混合可生成A。请回答下列问题:
(1)推断A、B、C、D的化学式:A_________、B___________、C_________、D__________
(2)A溶液中通入足量E反应的离子方程式为_______________________________________
(3)B溶液与C溶液反应的离子方程式为___________________________________________
21.(8分)(1)相同物质的量的钠、铝、铁与氯气完全作用,消耗氯气的物质的量之比为_________ 。 相同物质的量的钠、铝、铁与盐酸完全反应,恰好全部生成氯化物,则消耗等浓度盐酸的体积之比为_________。
(2)相同质量的钠、铝、铁与氯气完全作用,消耗氯气的量由大到小的顺序是 ;若与盐酸完全反应,恰好全部生成氯化物,则消耗等浓度盐酸的体积由大到小的顺序是 ___。
20、(15分)现有下列10种物质:①铁片;②饱和食盐水;③液态硫酸;④乙醇;⑤干冰;⑥熔融硝酸钾;⑦碳酸钙固体;⑧铝条;⑨苛性钠;⑩石墨。
(1)用序号回答:能导电的是______________,属于电解质的是___________________,属于非电解质的是___________________。
(2)写出①与水反应的化学方程式,并用双线桥表示电子转移的方向和数目。
__________________________________________________________________
(3)写出⑧与⑨的水溶液反应的离子方程式___________________________________,该反应的氧化剂为_______________,还原产物为__________________。
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质--碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。 C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。




 请用上述物质填空,并配平化学方程式:
请用上述物质填空,并配平化学方程式:
C+ ________+ H2SO4=== __________+ __________+

 Cr2(SO4)3+ H2O
Cr2(SO4)3+ H2O
若该反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com